
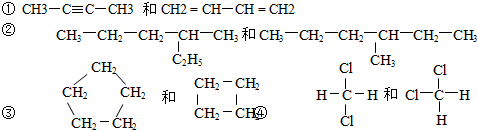
分析 具有相同分子式而结构不同的化合物互为同分异构体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同,
根据以上概念进行判断.
解答 解:③结构相似,分子间相差1个CH2原子团,它们互为同系物;
①分子式相同、结构不同,二者互为同分异构体;
②④的分子式、结构完全相同,二者为同一种物质;
故答案为:③;①;②④.
点评 本题考查了同系物、同分异构体、同一种物质的判断,题目难度不大,明确同系物、同分异构体的概念即可解答,注意掌握常见有机物组成、结构特点.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)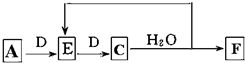
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 将1mol•L-1 NaAlO2溶液和1.5mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙溶液中溶质的质量分数均大于5% | |
| B. | 甲溶液中溶质的质量分数小于5%,乙、丙溶液中溶质的质量分数大于5% | |
| C. | 甲溶液中溶质的质量分数小于5%,乙的大于5%,丙的等于5% | |
| D. | 甲、乙、丙溶液中溶质的质量分数均等于5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | S | C. | SO32- | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同素异形体 | |
| B. | 11.5 g金属钠的物质的量为0.5 mol | |
| C. | 44 g CO2在标准状况下的体积为22.4 L | |
| D. | 该反应中碳元素发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ/mol,则H2O电解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为 $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则C的燃烧热为110.5 kJ/mol | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com