
| A. | 向红褐色的Fe(OH)3固体中加入过量盐酸 | |
| B. | 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 | |
| C. | 等物质的量的NaHCO3与Na2O2固体 | |
| D. | 向NaBr溶液中通入过量氯气 |
分析 A.Fe(OH)3固体中加入过量盐酸反应生成氯化铁,氯化铁水解生成氢氧化铁沉淀和氯化氢,盐酸挥发,氢氧化铁分解最终得到氧化铁;
B.等物质的量的硫酸铵和氯化钡反应生成硫酸钡和氯化铵,氯化铵受热分解;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应;
D.向NaBr溶液中通入过量氯气反应生成NaCl、溴,溴易挥发.
解答 解:A.向红褐色的Fe(OH)3固体中加入过量盐酸反应生成氯化铁,氯化铁会水解得到氢氧化铁和盐酸,盐酸挥发,灼烧氢氧化铁分解最终得到氧化铁,为纯净物,故A错误;
B.等物质的量的浓度、等体积的(NH4)2SO4与BaCl2溶液,反应生成硫酸钡和氯化铵,氯化铵分解生成氨气和HCl,氯化氢、氨气挥发,蒸干灼烧后的固体为硫酸钡,为纯净物,故B错误;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应,蒸干灼烧后的固体为碳酸钠和NaOH,为混合物,故C正确;
D.向NaBr溶液中通入过量氯气反应生成NaCl、溴,溴易挥发,蒸干灼烧后的固体为NaCl,为纯净物,故D错误;
故选:C.
点评 本题考查了元素化合物的性质,明确发生的化学反应及物质的性质是解答本题的关键,题目难度中等,注意盐类水解的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
如图I所示,甲、乙之间的隔板K和活塞F都可以左右移动,F受压力恒定.甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )
2C(g),反应达到平衡后,再恢复至原温度,则下列说法正确的是( )

A.达到平衡时,隔板K最终停留在0刻度左侧的2到4之间
B.若达到平衡时,隔板K最终停留在左侧1处,则乙中C的转化率小于50%
C.若达到平衡时,隔板K最终停留在左侧靠近2处,则乙中F最终停留在右侧的刻度大于4
D.如图II所示若x轴表示时间,则y轴可表示甲乙两容器中气体的总物质的量或A的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
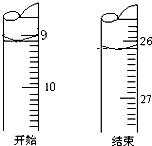 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a发生氧化反应,b发生还原反应 | B. | 碳棒上有气体逸出 | ||
| C. | 导线上有电流,电流方向从a→b | D. | 反应后a极质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③⑤④⑥⑦ | B. | ②①③⑤⑥④⑦ | C. | ②①⑤③⑥④⑦ | D. | ①②③⑤⑥④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com