
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
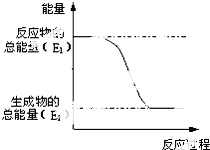 (1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,
(1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,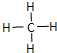 .一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
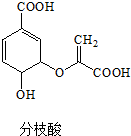
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | Ga的原子结构简图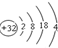 | |
| C. | 水分子的电子式: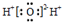 | |
| D. | 乙酸甲酯的结构简式:HCOOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
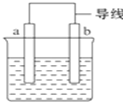 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为水果中一般含有各种芳香族有机酸,食用时能感到较强的酸味,刺激食欲 | |
| B. | 猪肉因含有 而有香味,该物质属于烃的衍生物,能发生加聚反应 而有香味,该物质属于烃的衍生物,能发生加聚反应 | |
| C. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| D. | 在分子筛固体酸作催化剂的条件下,用苯和丙烯反应制备异丙苯,符合绿色化学工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com