
A.Cu(OH)2 B.Cu(OH)2·CuSO4
C.2Cu(OH)2·2CuSO4 D.3 Cu(OH)2·CuSO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 一定条件 |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。
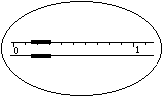 (二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
 5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢 (上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 | w= |
| g |
| 氢气的物质的量 | n= |
| mol |
| 反应前量气管A内读数 | V1= |
| ml |
| 反应后量气管A内读数 | V2= |
| ml |
| 氢气的体积 | V |
| ml |
| 室温 | T |
| K |
| 大气压 | P |
| Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值 (偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值 (偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省日照市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g)  2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g) 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。

(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。

III.目前工业合成氨的原理是:N2(g)+3H2(g)  2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。
回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3(g)
2NH3(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com