
| A. | 电解MgO制取Mg | |
| B. | 加热条件下用CO还原Ag2O制取Ag | |
| C. | 在A1和F2O3反应中,生成11.2gFe,转移电子数为0.6NA | |
| D. | 电解NaCl溶液制取Na |
分析 A.氯化镁、MgO都属于离子晶体,在熔融状态下都电离出阴阳离子而导电,但氯化镁的熔点小于氧化镁;
B.电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
C.在A1和F2O3反应中,生成11.2gFe=$\frac{11.2g}{56g/mol}$=0.2mol,电子转移0.2mol×3=0.6mol;
D.电解饱和NaCl溶液的实质是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
解答 解:A.镁为活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,而不采用电解氧化镁的方法冶炼镁,氯化镁的熔点低于氧化镁,如果电解氧化镁会浪费大量能源,所以用电解熔融氯化镁的方法冶炼镁,故A错误;
B.常温下,银易和其它物质反应生成化合物,所以在自然界中以化合态存在,银的金属性弱,可用加热Ag2O的方法冶炼,故B错误;
C.在A1和F2O3反应中,生成11.2gFe=$\frac{11.2g}{56g/mol}$=0.2mol,电子转移0.2mol×3=0.6mol,转移电子数为0.6NA,故C正确;
D.电解饱和NaCl溶液电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,实质是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得不到金属钠,故D错误;
故选C.
点评 本题考查了金属冶炼方法、金属制备原理、氧化还原反应电子转移数计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,元素原子的最外层电子排布呈现周期性变化 | |
| B. | 随原子序数递增,元素的原子半径呈现由大到小的周期性变化(惰性气体除外) | |
| C. | 随原子序数递增,元素的最高化合价重复出现从+1〜+7、最低化合价从-7〜-1的变化 | |
| D. | 随原子序数递增,元素的金属性和非金属性呈现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
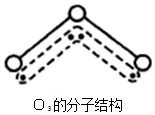 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
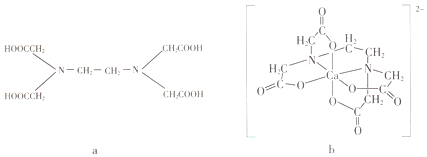 a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )| A. | b含有分子内氢键 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有共价键、离子键和配位键 | D. | a和b中的N原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中必含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在普通钢中加入镍、铬等多种元素可炼成不锈钢 | |
| B. | 硬铝、青铜、金箔都属于合金,合金的性能一般优于纯金属 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇和丙三醇 | B. | C6H5OH和C6H5CH2OH | ||
| C. | C3H6和C4H8 | D. | C3H8和C4H10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com