用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下(未配平):□KMnO4+□HCl--□KCl+□MnCl2+□Cl2↑+□H2O
(1)31.6g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl2在标准状况下的密度为3.17g/L,则产生的Cl2在标准状况下的体积为多少?有多少mol电子转移?
解:(1)Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,
由电子守恒及质量守恒定律可知,该反应为2KMnO
4+16HCl=2KCl+2MnCl
2+5Cl
2↑+8H
2O,
n(KMnO
4)=
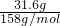
=0.2mol,则
2KMnO
4+16HCl=2KCl+2MnCl
2+5Cl
2↑+8H
2O 被氧化的HCl
2mol 16mol 5mol 10mol
0.2mol n(HCl) n(Cl
2) n(HCl)
被氧化则n(HCl)=0.8mol,
m(HCl)=1.6mol×36.5g/mol=58.4g,
n(HCl)
被氧化=1mol,
m(HCl)
被氧化=1mol×36.5g/mol=36.5g,
答:31.6g KMnO
4能使58.4gHCl发生上述反应,有36.5gHCl被氧化;
(2)n(Cl
2)=0.5mol,
m(Cl
2)=0.5mol×71g/mol=35.5g,
V=
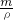
=
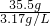
=11.2L,
转移电子为0.5mol×2×(1-0)=1mol,
答:产生的Cl
2在标准状况下的体积为11.2L,转移电子为1.0mol.
分析:(1)根据反应的化学方程式计算,根据Cl元素化合价的变化可知,16molHCl参加反应时,有10molHCl被氧化;
(2)根据V=
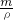
计算氯气的体积.
点评:本题考查氧化还原反应的计算,题目难度中等,注意有关反应的化学方程式的计算以及物质的量的相关计算公式的运用.

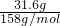 =0.2mol,则
=0.2mol,则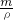 =
=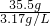 =11.2L,
=11.2L,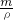 计算氯气的体积.
计算氯气的体积.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案