
分析 25℃时,0.1mol.l-1醋酸达到平衡时的pH约为3,如果在此溶液中加入等体积的pH=5的盐酸,相当于稀释醋酸,促进醋酸电离;
若向原醋酸中加入少量醋酸钠晶体,醋酸钠电离出的醋酸根离子导致溶液中醋酸根离子浓度增大,抑制醋酸电离.
解答 解:25℃时,0.1mol.l-1醋酸达到平衡时的pH约为3,如果在此溶液中加入等体积的pH=5的盐酸,相当于稀释醋酸,促进醋酸电离,平衡正向移动;
若向原醋酸中加入少量醋酸钠晶体,醋酸钠电离出的醋酸根离子导致溶液中醋酸根离子浓度增大,抑制醋酸电离,平衡逆向元素,则溶液中氢离子浓度降低,溶液的pH增大,故答案为:向右;增大.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离影响因素是解本题关键,会根据离子浓度变化确定平衡移动方向,题目难度不大.


科目:高中化学 来源: 题型:解答题
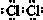 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+=SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀,这说明铁钉发生了吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4电离方程式H2SO4=2H++S6++4O2- | |
| B. | H2、D2、T2互为同位素 | |
| C. | 18g H2O含有的电子数为10NA | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4和C3H6O | B. | C3H6和C3H8O2 | C. | C3H6O2和C3H8O | D. | C3H8O和C4H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 5:1 | C. | 1:3 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42% | B. | 60% | C. | 70% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
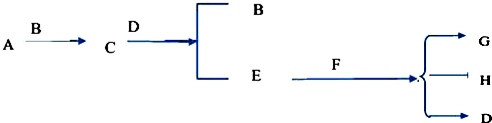
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com