
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯。提取柠檬烯的实验操作步骤如下:柠檬烯![]()
①将12个橙子皮剪成细碎的碎片,投人乙装置中,加入约30mL水,
②松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧, 打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。下列说法不正确的是
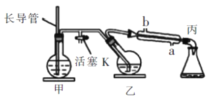
A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B.为达到实验目的,应将甲中的长导管换成温度计
C.蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热
D.要得到纯精油,还需要用到以下分离提纯方法:分馏、蒸馏
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I是中学化学中常见的九种化合物,其中B常温下为无色无味透明的液体,C的焰色反应火焰呈黄色,E是红棕色的固体;X、Y是两种常见的单质,其中X常温常压下为气体.
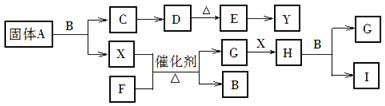
根据上面框图关系回答下列问题:
(1)A的化学式为______,常温下A的颜色为______,I的化学式为______.
(2)写出X+F![]() G+B的化学方程式:______.
G+B的化学方程式:______.
(3)写出实验室中用两种固体药品制取F气体的化学方程式:______.
(4)写出“![]() ”反应的离子方程式:______.
”反应的离子方程式:______.
(5)写出“![]() 金属单质
金属单质 两性氧化物”的化学方程式:______.
两性氧化物”的化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1 盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法正确的是( )

A.常温下,Kb(NH3·H2O)约为1×10-3
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
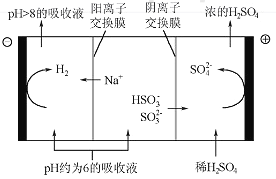
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) ![]() CH3OH(g) △H<0
CH3OH(g) △H<0
① 该反应的平衡常数表达式为____________。
② 若容器容积不变,下列措施可增加甲醇产率的是___________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:① CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.7 kJ·mol-1
CH3OH(g) △H1 =-90.7 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ·mol-1
③ CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =-41.2 kJ·mol-1
则 3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
CH3OCH3(g)+CO2(g)的 △H =_______kJ·mol-1
(3)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴 (CoSO4)混合溶液,插上两根惰性电极,通电,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:

① 检验电解时产生的CO2气体,井穴板穴孔内应盛放___________溶液。
② 写出净化甲醇的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如图所示,有关其性质叙述不正确的是( )

A.该有机物分子式为C10H8O5
B.分子中有四种官能团
C.该有机物能发生加成、氧化、取代等反应
D.1mol该化合物最多能与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种常见元素,其中A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等且有2个未成对电子;E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是___,第一电离能最大的是___。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是____。
(3)A、B形成的化合物M与氢氰酸(HCN)反应可得丙烯腈(H2C=CH—C≡N),则M的结构式为___,丙烯腈分子中碳原子轨道杂化类型是____。
(4)由C元素形成的一种离子与BD2互为等电子体,该离子的结构式为____。
(5)基态E原子的核外电子排布式为____,如图是D、E形成的某种化合物的晶胞结构示意图,该晶体的化学式为____。

(6)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+,1mol[E(CA3)4]2+中含有σ键的数目约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.熔融状态的![]() 不能导电,
不能导电,![]() 的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类
的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类![]() 是一种共价化合物、非电解质、盐、分子晶体
是一种共价化合物、非电解质、盐、分子晶体
B.单质熔点![]() ,是热和电的良导体,该晶体最可能是分子晶体
,是热和电的良导体,该晶体最可能是分子晶体
C.![]() 晶体属于原子晶体,1mol的
晶体属于原子晶体,1mol的![]() 晶体含有
晶体含有![]() 的
的![]() 键
键![]() 为阿伏加德罗常数
为阿伏加德罗常数![]()
D.固态金属单质都是金属晶体,金属晶体含有金属键,非金属单质晶体都是分子晶体,分子晶体主要含有共价键和范德华力,有些分子晶体还含有氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com