
【题目】现有下列6种物质
①![]() ②
② ③
③![]()
④CH3-CH=CH-CH3 ⑤![]() ⑥
⑥![]()
(1)用于制造炸药TNT的是____(填序号)。
(2)具有两性的是______(填序号)。
(3)有机物①的沸点比②______(填“高”或“低”)
(4)有机物④的名称是___________
(5)有机物④形成的高聚物结构简式为__________________
(6)检验有机物⑥中官能团的试剂是_________________
【答案】③ ⑤ 低 2-丁烯 ![]() 银氨溶液或新制的氢氧化铜
银氨溶液或新制的氢氧化铜
【解析】
(1) TNT的主要成分为三硝基甲苯;
(2)氨基具有碱性,羧基具有酸性,因此氨基酸具有两性;
(3)乙二醇的相对分子质量比乙醇大,且含有2个羟基,据此分析判断;
(4)有机物④(CH3-CH=CH-CH3)中含有4个碳原子,且在2号碳原子上含有碳碳双键,根据烯烃的命名规则命名;
(5)有机物④中含有碳碳双键,能够通过加聚反应形成高聚物;
(6)有机物⑥中含有醛基,结合乙醛的性质分析解答。
(1)制造炸药TNT(三硝基甲苯)是用甲苯和浓硝酸发生硝化反应制得的,故答案为:③;
(2)氨基具有碱性,羧基具有酸性,因此氨基酸具有两性,故答案为:⑤;
(3)乙二醇的相对分子质量比乙醇大,且含有2个羟基,形成的氢键更多,因此有机物①的沸点比②低,故答案为:低;
(4)有机物④(CH3-CH=CH-CH3)中含有4个碳原子,且在2号碳原子上含有碳碳双键,名称为2-丁烯,故答案为:2-丁烯;
(5)有机物④中含有碳碳双键,能够通过加聚反应形成高聚物,高聚物结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)有机物⑥中含有醛基,醛基能够与银氨溶液或新制的氢氧化铜反应生成光亮的银镜或生成红色沉淀,故答案为:银氨溶液或新制的氢氧化铜。


科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________;
以及此热化学方程式的平衡常数K=________(用K1、K2、K3表示)。
(2)①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________。

②已知:测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为____;
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式:________________。
(3)NO2会污染环境,可用Na2CO3溶液吸收NO2 并生成CO2,已知9.2gNO2气体和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶被呈弱碱性,则溶液中存在的所有离子浓度大小关系是____________________________。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。

①由图I知,当废气中的NO含量增加时,宜选用___________法提高脱氮的效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为___________。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:
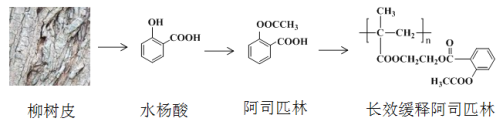
(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成

①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
③以烃A为原料,合成聚甲基丙烯酸的路线如下:

已知:

(R、R’为烃基或氢原子)
请填写有机物A~D的结构简式,在所有箭头上标注试剂和条件_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)HClO___________________________________________________
(2)Ba(NO3)2______________________________________________
A层:(3)NaHSO4____________________________________________
NH3·H2O_____________________________________________________
B层:(3)H2CO3______________________________________________
Fe(OH)3____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和砷均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为________。同一周期As、Ge、Se三种元素的第一电离能由大到小的顺序为________________。
(2)Na3AsO3中所含阴离子的立体构型为___________,写出一个与AsO33-具有相同空间构型和键合形式的分子____________________(填化学式)。
(3)在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为__________,_________;1mol尿素分子中,![]() 键的数目为___________。
键的数目为___________。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是__________________。

(5)某砷镍合金的晶胞结构如图所示,阿伏加德罗常数的值为NA,则该晶体的密度![]() =________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
=________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物环丁基甲酸(H)是一种应用广泛的有机物,合成化合物H的路线如图:

(1)A属于烯烃,其结构简式为______________,由A→B的反应类型是___________。
(2)D中官能团的名称是_________________,由D→E的反应类型是________________。
(3)E的名称是_______________。
(4)写出F与NaOH溶液反应的化学方程式_______________________。
(5)M是G的同分异构体,且满足以下条件:①能使溴的四氯化碳溶液褪色;②1mol M与足量饱和NaHCO3反应产生88g气体;③核磁共振氢谱为2组峰;则M的结构简式为(不考虑立体异构,只写一种)________________,N是比M少一个碳原子的同系物,则N的同分异构体有_________种。
(6)参照上述合成路线,以![]() 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备![]() 的合成路线________________________________。
的合成路线________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示页岩气中某些烃类的结构模型:
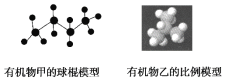
(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com