
分析 (1)通过玻璃棒的搅拌可使混合物充分接触而促进反应进行;烧杯和玻璃片之间的水结冰会将二者粘在一起;
(2)形成化学键释放能量,燃烧放热、有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,大多数分解反应是吸热反应,氧化反应、酸碱中和、炸药爆炸是放热反应;
(3)等质量的硫蒸气具有的能量比硫固体多;
(4)依据中和热的概念是强酸强碱的稀溶液完全反应生成1mol水放出的热量分析;
(5)根据旧键断裂吸收的能量减去新键生成释放的能量值即为反应热解答,燃烧反应为放热反应.
解答 解:(1)固体参加的反应,搅拌可使混合物充分接触而促进反应进行,通过玻璃片上结冰现象,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,
故答案为:搅拌,使反应物充分接触,促进反应;玻璃片上水结冰而与烧杯粘在一起;
(2)形成化学键、燃料的燃烧、葡萄糖在体内的氧化反应、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如二氧化碳与C的反应属于吸热反应,所以不一定释放能量的为化合反应,
故答案为:C;
(3)等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,
故答案为:B;
(4)1mol H2SO4与NaOH溶液恰好完全反应时生成2molH2O,放出QkJ热量,中和热指生成1mol水放出的热量,则H2SO4与NaOH反应则中和热为:$\frac{Q}{2}$kJ/mol,
故答案为:$\frac{Q}{2}$;
(5)1molH2O中含2molH-O键,断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ,则成1molO-H键放出Q3kJ热量,对于反应H2(g)+$\frac{1}{2}$O2(g)=H2O(g),断开1 mol O=O键和1 molH-O键所吸收的能量Q1+$\frac{1}{2}$Q2,生成新键释放的能量2Q3,该反应放热,2Q3-(Q1+$\frac{1}{2}$Q2)>0,即2Q1+Q2<4Q3,
故答案为:C.
点评 本题考查了化学反应与能量变化,注意掌握中和热的概念,(5)1molH2O中含2molH-O键为解答易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
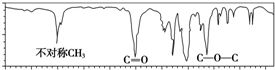
| A. | CH3COOCH2CH3 | B. | CH3CH2COOH | C. | HCOOCH2CH2CH3 | D. | (CH3)2CHCH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 往待测液中滴加硝酸银溶液 | 有白色沉淀出现 | 待测液中含有Cl- |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(SO2):饱和NaHCO3溶液 | B. | NO(NO2):水 | ||
| C. | Cl2(HCl):NaOH溶液 | D. | Na2CO3固体(NaHCO3):加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com