
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=—lgc(OH),下列正确的是
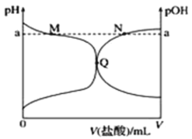
A.M 点所示溶液中可能存在:c(Cl)>c(NH4+)
B.M 点到Q点所示溶液中水的电离程度先变大后减小
C.Q 点盐酸与氨水恰好中和
D.N 点所示溶液中可能存在:c(NH4+)+c(NH3·H2O)=c(Cl)
科目:高中化学 来源: 题型:
【题目】已知![]() 为直线形结构,
为直线形结构,![]() 为平面正三角形结构,
为平面正三角形结构,![]() 为三角锥形结构,请推测COS、
为三角锥形结构,请推测COS、![]() 、
、![]() 的空间构型:______________________________。
的空间构型:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为NaCl和CsCl的晶体结构,下列说法错误的是( )
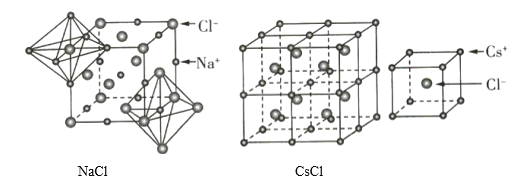
A.NaCl和CsCl都属于AB型的离子晶体
B.NaCl和CsC1晶体中阴、阳离子个数比相同,所以二者的阴、阳离子的配位数也相同
C.CsCl晶体中阴、阳离子的配位数均为8
D.NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子的半径比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
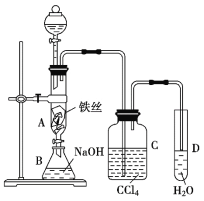
(1)反应后观察到A中反应液微沸,有红棕色气体充满A容器,写出A中反应的化学方程式__;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入__溶液,若产生淡黄色沉淀,则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
A.加入适量小苏打B.加入适量稀硝酸
C.加入适量烧碱固体D.加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2gSiH4自燃放出热量89.2kJ,其热化学方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
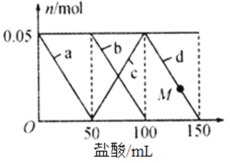
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com