
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.05molH2O2中含有的阴离子数为0.05NA | |
| C. | 3mol单质Fe与足量水蒸气在一定条件下反应失去9NA 个电子 | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
分析 A、求出甲醇的物质的量,然后根据1mol甲醇中含5mol共价键来分析;
B、双氧水是共价化合物;
C、铁和水蒸汽反应后变为+$\frac{8}{3}$价;
D、0.2gD216O的物质的量为0.01mol.
解答 解:A、3.2g甲醇的物质的量为0.1mol,而1mol甲醇中含5mol共价键,故0.1mol甲醇中含0.5NA个共价键,故A错误;
B、双氧水是共价化合物,不含阴离子,故B错误;
C、铁和水蒸汽反应后变为+$\frac{8}{3}$价,故3mol铁和水蒸气反应后转移8mol电子即8NA个,故C错误;
D、0.2gD216O的物质的量为0.01mol,而D216O中含10个质子、10个电子和10个中子,故0.01molD216O中含有的质子、电子和中子数均为0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
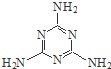 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )| A. | 17:44 | B. | 22:17 | C. | 17:22 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
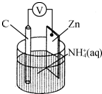
| A. | 碳电极上发生还原反应 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 负极上发生的反应为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 | |
| B. | 分离苯和硝基苯的混合物,可用蒸馏法 | |
| C. | 除去苯中的杂质苯酚可加入浓溴水后过滤 | |
| D. | 从粗苯甲酸中提纯苯甲酸,可用重结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡后静置 | 下层呈紫红色 | 氧化性:Fe3+>I2 |
| B | 向稀硫酸中加入少量铁粉 | 溶液变为黄色 | 稀硫酸将Fe氧化成Fe3+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞溶液,然后逐滴加入稀盐酸至红色接近消失时停止,静置 | 试管里出现凝胶 | 非金属性:Cl>Si |
| D | 葡萄糖溶液与新制的氢氧化铜混合加热 | 有砖红色沉淀生成 | 葡萄糖分子中有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.
T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com