
| A. | ③⑤⑥⑦⑧ | B. | ③⑤⑥ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥ |
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应等;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),八水合氢氧化钡与氯化铵的反应,以此解答该题.
解答 解:①锌粒与稀H2SO4反应制取H2,为活泼金属与酸的反应,为放热反应,故错误;
②氢气在氧气中燃烧,放出大量的热,为放热反应,故错误;
③碳酸钙高温分解成氧化钙和二氧化碳,为吸热反应,故正确;
④氢氧化钾和硫酸中和,放出热量,为放热反应,故错误;
⑤Ba(OH)2•8H2O与NH4Cl反应为吸热反应,故正确;
⑥氢气还原氧化铜,需要加热条件下进行,停止加热反应停止,为吸热反应,故正确;
⑦葡萄糖在人体内氧化分解,为人体提供能量,为放热反应,故错误;
⑧钢铁制品生锈的反应,为缓慢的氧化还原反应,为放热反应,故错误.
故选B.
点评 本题考查吸热反应和放热反应,为高频考点,侧重于双基的考查,难度不大,明确常见的吸热反应和放热反应是解题的关键,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| B. | ①加入适量的氯化铵晶体后,溶液的pH减小 | |
| C. | ①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-) | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | H2O和D2O互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图所示装置检验溴乙烷发生消去反应,生成乙烯 | |
| B. |  利用图所示装置配置银氨溶液 | |
| C. | 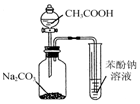 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. | 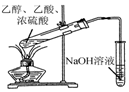 利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
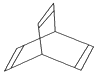 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示.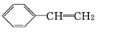 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH=Na++OH- | B. | Na2SO4=2Na++SO4-2 | ||
| C. | H2SO4=H2++SO42- | D. | Ca(NO3)2=Ca2++2(NO3)2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com