
【题目】(12分)现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K__ ___1(填“>”、“<”或“=”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“>”、“<”或“=”)。
【答案】(12分)(每空3分)(1) < (2) ①逆反应 ② 0≤x<3 (3) <
【解析】
(1).对于放热反应,升高温度,平衡常数减小;(2).①.反应混合物各物质的化学计量数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数K的关系判断;②.用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<K,据此计算判断;(3). 加入6mol氢气所达到的平衡,可以看成在加入5mol氢气达到平衡后再加入1mol氢气,平衡向逆反应方向移动,再根据平衡移动原理判断。
(1). CO(g)+H2O(g)![]() CO2(g)+H2(g)为放热反应,在850℃时,K=1,升高温度到950℃时,平衡逆向移动,平衡常数K减小,即达到平衡时K小于1,故答案为:小于;
CO2(g)+H2(g)为放热反应,在850℃时,K=1,升高温度到950℃时,平衡逆向移动,平衡常数K减小,即达到平衡时K小于1,故答案为:小于;
(2).①. 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,当x=5.0时,因CO(g)+H2O(g)![]() CO2(g)+H2(g)化学计量数均为1,可以利用物质的量代替平衡浓度求浓度商,Qc=
CO2(g)+H2(g)化学计量数均为1,可以利用物质的量代替平衡浓度求浓度商,Qc=![]() =
=![]() >K=1,平衡逆向移动,故答案为:逆反应;
>K=1,平衡逆向移动,故答案为:逆反应;
②.若要使上述反应开始时向正反应方向进行,应满足Qc小于K,Qc=![]() <1,x<3.0,则x应满足的条件是小于3.0,故答案为:x<3.0;
<1,x<3.0,则x应满足的条件是小于3.0,故答案为:x<3.0;
(3).加入6mol氢气所达到的平衡,可以看成在加入5mol氢气达到平衡后再加入1mol氢气,平衡向逆反应方向移动,移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原平衡时的体积分数,即a%<b%,故答案为:小于。


科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A.苯、氯乙烯、丙烯分子中所有原子均在同一平面
B.汽油、柴油、植物油都是碳氢化合物
C.甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种
D.乙醇、甲苯和溴苯可用水鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是
①纯碱 ②食盐水 ③石灰水 ④氢氧化钠 ⑤液态氧 ⑥氯酸钾
A. 碱——①④ B. 纯净物——③④⑤
C. 盐——①⑥ D. 混合物——②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组大小顺序不正确的是
A. 酸性:H2SiO3﹤H3PO4﹤H2SO4 B. 热稳定性:H2Se﹤H2S﹤H2O
C. 还原性:HI﹥HBr﹥HCl D. 金属的还原性:Na﹤Mg﹤Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+ O2(g) = 2H2O(g),H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则2mol H2完全燃烧放出的热量为
A. 480 kJ B. 916 kJ C. 960 kJ D. 190 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是_________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是______________;所求中和热的数值会________(填“相等”或“不相等”),理由是_________________。若他测得Δt=3℃,则中和热ΔH为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.用金属钠可区分乙醇和乙醚B.用高锰酸钾酸性可区分乙烷和3-己烯
C.用水可区分苯和溴苯D.用新制的银氨溶液可区甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行以下实验探究:
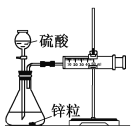

Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
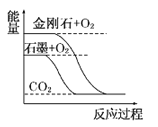
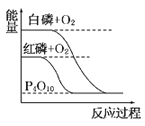
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com