


科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液 |
| 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | | |
| 第二种方法 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
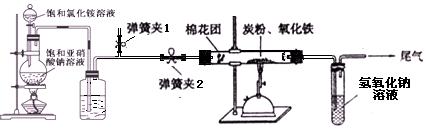 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验内容 | 实验现象 | 实验结论 |
(1)Na、Mg(条)、K与水反应 | 同一周期自左而右元素原子失电子的能力逐渐______;同一主族自上而下元素原子失电子能力依次______. | |
(2)Mg、Al与酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.假设法 | B.观察法 | C.比较法 | D.实验法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
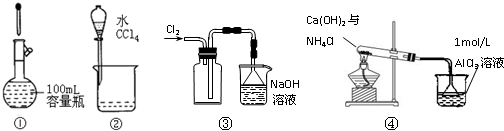
| A.图①表示正确的定容操作 |
| B.图②表示实验室分离水和CCl4 |
| C.实验室可采用图③所示装置收集Cl2 |
| D.图④烧杯中先出现白色沉淀,后溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com