
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。反应中镁和铝的( )

A. 物质的量之比为3∶2
物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间
B.0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L
C.0.2 mol·L-1 Na2S溶液中含有的S2-数目小于0.2NA
D.在反应Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:
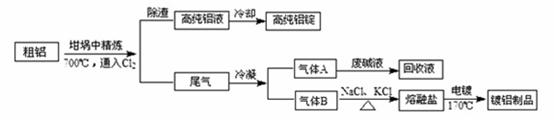
(注 :NaCl熔点为801℃;AlCl3在181℃升华)
:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和② 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为 。
(4)镀铝电解池中,金属铝为 极,熔融盐电镀中铝元素和氯元素主要以AlCl4― 和Al2Cl7―形式存在,铝电镀的主要电极反应式为 。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除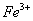 外还可能含有
外还可能含有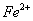 。若要确认其中的
。若要确认其中的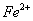 ,应先用 选填序号)。
,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性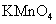 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
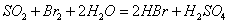
然后加入足量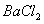 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中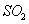 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中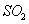 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有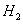 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
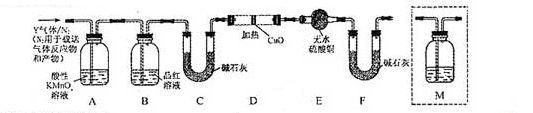
(3)装置B中试剂的作用是 。
(4)认为 气体Y中还含有Q的理由是 (用化学方程式表示)。
气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确 认Q的存在,需在装置中添加M于 (选填序号)。
认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有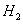 ,预计实验现象应是 。
,预计实验现象应是 。
(7)若要测定限定体积气体Y中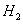 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml 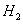 ),除可用测量
),除可用测量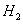 体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。

请根据上述信息回答:
(1)H中含氧官能团的名称是____________,B→I的反应类型为____________。
(2)只用一种试剂鉴别D、E、H,该试剂是____________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为____________。
(4)D和F反应生成X的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在_________部分发生反应,在______部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为_________;加入硅、锰和铝的目的是_______。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹_______(填“前”或“后”)加入,原因是_____________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是_________。从环保和经济角度考虑,上述尾气经处理可用作________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
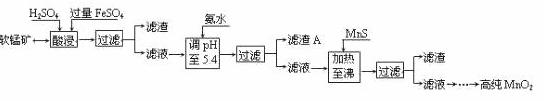
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为  。
。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列化学方程式中,能够用离子方程式Ba2++SO42﹣=BaSO4↓表示的是( )
|
| A. | BaCl2+K2SO4=BaSO4↓+2KCl |
|
| B. | BaCO3+H2SO4=BaSO4↓+CO2↑+H2O |
|
| C. | Ba(OH)2+H2SO4=BaSO4↓+2H2O |
|
| D. | Ba(OH)2+2KHSO4=BaSO4↓+K2SO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com