

���� ��1��Ũ�������ǿ�ҵĸ�ʴ�ԣ�
��2������������Һ��ʵ���������ѡ�������������
��3������c=$\frac{1000�Ѧ�}{M}$����ŨH2SO4�����ʵ���Ũ�ȣ��ٸ�����Һϡ��ǰ�����ʵ��������������Ũ������������������Ũ��������ѡ����Ͳ���
��4���������������ʵ����ʵ��������Һ�������Ӱ�죬����c=$\frac{n}{v}$�����ж�
��� �⣺��1��Ũ�������ǿ�ҵĸ�ʴ�ԣ�����Ӧ��ǩ��Ӧӡ�и�ʴƷ��־��
��ѡ��D��
��2�����������м��㡢��ȡ��ϡ�͡���Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ���������Ͳ��ȡ���õ���ͷ�ιܣ�Ũ���ᣬ���ձ���ϡ�ͣ��ò��������裬��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ��2-3�Σ���ϴ��Һת�Ƶ�����ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ�
���ṩ��������֪����Ҫ�����У�500mL����ƿ����������
�ʴ�Ϊ��100mL����ƿ����������
��3��ŨH2SO4�����ʵ���Ũ��c=$\frac{1000��1.84��98%}{98}$mol/L=18.4mol/L������480mL 1mol•L-1��ϡ���ᣬʵ�������Ƶ���500mL 1mol•L-1��ϡ���ᣬ����ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬��Ũ��������ΪxmL������xmL��18.4mol/L=500mL��1mol/L����ã�x��27.2mL����Ҫѡ��50mL��Ͳ������B��ȷ��
�ʴ�Ϊ��27.2��B��
��4��A������Ͳ��ȡŨ����ʱ�����ӿ̶���ȡŨ���ᣬ��ȡŨ���������������ʵ����ʵ���ƫ��������ҺŨ��ƫ�ߣ���A��ȷ��
B������ʱ����������ƿ�̶��߽��ж��ݣ�����������Һ�����С��������ҺŨ��ƫ�ߣ���B��ȷ��
C����Һ���������������ʣ�Ũ����ϡ�ͣ��ų��������ȣ��ܽ��δ�ָ���������ת�Ƶ�����ƿ�ж��ݣ�����������Һ�����С��������ҺŨ��ƫ�ߣ���C��ȷ��
D��ת����Һʱ��������������Һ��������ƿ���棬��������ƿ�е����ʵ����ʵ�����С��������ҺŨ��ƫ�ͣ���D����
E������ƿ������ˮϴ�Ӻ�δ���������������ˮ������Һ�������Ӱ�죬������ҺŨ����Ӱ�죬��E����
F�����ݺ�����ƿ����ҡ�Ⱥ���Һ����ڿ̶��ߣ��㲹�伸��ˮ���̶ȴ���������Һ���ƫ��������ҺŨ��ƫ�ͣ���F����
��ѡ��ABC��
���� ���⿼��������һ�����ʵ���Ũ�ȵķ�������Ŀ�Ѷ��еȣ�ע���c=$\frac{n}{v}$��������ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��CuSO4��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O | |
| B�� | ��CuSO4��CuO+H2SO4��ϡ��=CuSO4+H2O | |
| C�� | ��Cu��NO3��2��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O | |
| D�� | ��Cu��NO3��2��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��������һ������ | B�� | ���������ǿ��ԭ�� | ||
| C�� | ������ȶ�������ֽ� | D�� | ���������Ư���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2 | B�� | SO2 | C�� | NO2 | D�� | NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
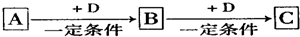
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʯ�������ǻ�ѧ�仯�����������ɸ��������仯 | |
| B�� | ����������ʢ������ͭ��Һ�������ױ���ʴ | |
| C�� | �����ֶ�������̼�Ͻ����������ܺ���;�ϲ�� | |
| D�� | ���Ƕ�����ȫ�ܽ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ���� | c��HA��/mol•L-1 | c��NaOH��/mol•L-1 | �����Һ��pH |
| �� | 0.1 | 0.1 | pH=a |
| �� | 0.2 | 0.2 | pH=9 |
| �� | c1 | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
| A�� | a=7 | |
| B�� | ��������Һ����ˮ�������c��OH-��=10-5 mol•L-1 | |
| C�� | c1=0.2 | |
| D�� | ������Һ�У�c��Na+����c��A-����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ӣ�����������Ų���ȫ��ͬ�����仯ѧ����һ����ȫ��ͬ | |
| B�� | ����ԭ���γɵ����ӣ�һ������ϡ������Ԫ��ԭ�ӵĺ�������Ų� | |
| C�� | ��ԭ�������������Ų���ͬ����һ��������ͬ�������� | |
| D�� | ij����M���L���ϵĵ��Ӿ�ΪK���4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����۵��ɵ͵��ߣ�CF4��CCl4��CBr4��CI4 | |
| B�� | Ӳ���ɴ�С�����ʯ��̼���裾����� | |
| C�� | ���ȶ��ԣ�HF��HI��HBr��HCl | |
| D�� | �۵��ɸߵ��ͣ�NaF��NaCl��NaBr��NaI |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com