
【题目】某温度下,将氢气和碘蒸气各1mol的气态混合物充入10L的密闭容器中.发生反应H2(g)+I2(g)=2HI(g).2分钟后达到平衡后.测得C(H2)=0.08molL﹣1 ,
(1)求该反应的平衡常数.
(2)求2分钟内的H2的反应速率.
【答案】
(1)
解:在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得c(H2)=0.08mol/L,
H2 +I2 2HI
起始量(mol/L) 0.10 0.10 0
变化量(mol/L) 0.02 0.02 0.04
平衡量(mol/L) 0.08 0.08 0.04
则该温度下该反应的平衡常数为:K= ![]() =0.25;
=0.25;
答:该反应的平衡常数为0.25;
(2)
解:达到平衡后测得c(H2)=0.08mol/L,反应前氢气的浓度为:![]() =0.10mol/L,则2min内氢气的平均反应速率为:v(H2)=
=0.10mol/L,则2min内氢气的平均反应速率为:v(H2)=![]() =0.01mol/(Lmin),
=0.01mol/(Lmin),
答:2分钟内氢气的平均反应速率为0.01mol/(Lmin)
【解析】(1)依据化学平衡的三段式列式计算物质的平衡浓度,结合平衡常数概念计算得到;(2)反应前氢气的浓度为: ![]() 0.10mol/L,根据v(H2)=
0.10mol/L,根据v(H2)= ![]() 计算出2分钟内的H2的反应速率.
计算出2分钟内的H2的反应速率.
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】常见物质之间的转化如下图所示:
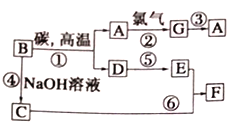
其中B常被用于制造光导纤维,其对应的单质的结构与金刚石的结构是相似的。
(1)试推测:A______,F___________(写化学式)
(2)试写出反应④的离子方租式:__________。
(3)写出反应①的化学方程式____________。
(4)在反应①中,碳的作用是______,当生成1molA时,转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、Al、S是常见的六种元素.完成下列填空:
(1)碳元素有12C、13C和14C等同位素.在14C原子中,核外存在对自旋相反的电子.
(2)碳在形成化合物时,其所成化学键以共价键为主,原因是 .
(3)任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式 .
(4)上述元素可组成盐NH4Al(SO4)2 . 向10mL1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下.
①NH4Al(SO4)2溶液中所有离子的浓度由大到小的顺序是 , 请解释阳离子浓度差异的原因 .
②写出N点反应的离子方程式 .
③若向10mL1mol/L NH4Al(SO4)2溶液中加入20mL1.2mol/LBa(OH)2溶液,充分反应后,产生沉淀mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属铝的叙述中,说法不正确的是
A.铝的化学性质很活泼,但在空气中不易锈蚀
B.铝是比较活泼的金属,在化学反应中容易失去电子,表现出还原性
C.铝箔在空气中受热可以熔化,且发生剧烈燃烧
D.铝箔在空气中受热可以熔化,但由于氧化膜的存在,熔化的铝并不滴落
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 物质的量即微粒的数量
B. 1 mol任何物质都含有6.02×1023个原子
C. 28g CO的体积为22.4L
D. 在同温同体积时,气体物质的物质的量越大,则压强越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。关于钠的叙述中,正确的是
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.加热时,金属钠剧烈燃烧,产生黄色火焰
D.金属钠着火可以用泡沫灭火器或用干燥的沙土灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写错误的是
A.钠与水反应:2Na+2H2O===2Na++2OH+H2↑
B.适量钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.适量钠与盐酸反应:2Na+2H+===2Na++H2↑
D.适量钠跟氯化钾溶液反应:2Na+2H2O===2Na++2OH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
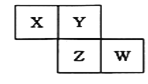
A. Z、X分别与Y形成的化合物均能与NaOH溶液发应生成盐和水
B. 最高价氧化物对应水化物的酸性: Z>W>X
C. 4种元素的单质中,Z单质的熔、沸点最高且易溶于水
D. W单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。
A是某含硫矿石的一种主要成分,D是赤铁矿的主要化学成分,B、C、F、H是常见的气体,F与H的组成元素相同,且F的相对分子质量比H的大16,G是常见的强酸。E是最常见的无色液体。
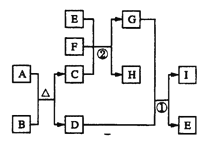
请回答下列问题:
(1)E的电子式为______
(2)I的化学式为______
(3)写出反应①的化学方程式:____________
(4)写出反应②的离子方程式:____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com