
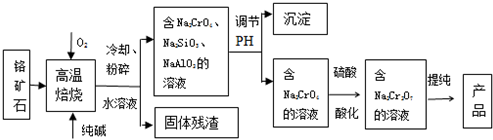
分析 以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠,二氧化碳,水浸后过滤得到滤渣FeO,滤液为Na2CrO4,Na2SiO3,NaAlO2;调节溶液PH沉淀硅酸跟离子和偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化生成重铬酸钠溶液,通过提纯得到重铬酸钠.
(1)铬矿石中加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠,二氧化碳,依据原子守恒和电子守恒配平写出化学方程式;硫酸酸化使Na2CrO4转化为Na2Cr2O7,依据电荷守恒写出离子方程式;
(2)①根据题意废水与K2Cr2O7溶液发生氧化还原反应,再用Fe2+把多余的Cr2O72-反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,则与废水反应反应的K2Cr2O7的物质的量=加入的K2Cr2O7的物质的量-与Fe2+反应的K2Cr2O7的物质的量,利用2K2Cr2O7~3O2可求出废水中化学耗氧量即COD;
②铁离子完全沉淀的浓度为10-5mol/L,铬离子不沉淀的浓度为0.1mol/L,由溶度积常数计算溶液氢氧根离子浓度,结合离子积常数换算氢离子浓度计算得到溶液pH;
(3)K2Cr207的溶解度小于Na2Cr207的溶解度,根据溶解度大的物质能转化为溶解度小的物质解答;
(4)酸性的K2Cr207溶液常用于酒驾的检验,铬元素化合价+6价降低到+3价,碳元素化合价升高从-2价升高为0价,据此书写离子反应方程式;Cr2O72-和Cr3+在溶液中分别显橙色和绿色,可利用颜色的变化检验乙醇,现象据此解答.
解答 解:(1)由图示可知Cr2O3在高温焙烧时生成Na2CrO4,发生氧化还原反应,反应的化学方程式为:2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2,在酸性环境下,CrO42-转化为Cr2O72-,在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2;2CrO42-+2H+?Cr2O72-+H2O;
(2)①样品100.00mL,酸化后加入c1mol/L的Na2Cr2O7溶液 V1mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用4mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2mL,废水与K2Cr2O7溶液发生氧化还原反应,再用Fe2+把多余的Cr2O72-反应:
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
1 6
n C2mol/L×V2×10-3L
n=$\frac{{C}_{2}{V}_{2}}{6}$×10-3mol,
则100ml废水中,与废水反应反应的K2Cr2O7的物质的量=加入的K2Cr2O7的物质的量-与Fe2+反应的K2Cr2O7的物质的量=c1mol/L×V1×10-3L-$\frac{{C}_{2}{V}_{2}}{6}$×10-3mol,
1L废水水样中被还原的K2Cr2O7的物质的量=(c1V1-$\frac{{C}_{2}{V}_{2}}{6}$)×10-2mol,
利用2K2Cr2O7~3O2可求出废水中化学耗氧量即COD,
2K2Cr2O7 ~3O2
2 3×32
(c1V1-$\frac{{C}_{2}{V}_{2}}{6}$)×10-2mol m
m=(48c1V1-8c2V2)×10-2g=(480c1V1-80c2V2)mg,该水样的COD为(480c1V1-80c2V2)mg/L,
故答案为:480C1V1-80C2V2;
②反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1mol/L,要使Fe3+沉 淀完全而Cr3+还未开始沉淀,需要c(Fe3+)=10-5mol/l时铁离子沉淀完全,由溶度积常数Ksp=c(Fe3+)c3(OH-),c3(OH-)=$\frac{4.0×1{0}^{-38}}{1×1{0}^{-5}}$=4.0×10-33 ,c(OH-)=$\root{3}{4}$×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{\root{3}{4}×1{0}^{-11}}$=$\frac{1{0}^{-14}}{1{0}^{0.2}×1{0}^{-11}}$=10-3.2,pH=-lgc(H+)=3.2;
Cr3+还未开始沉淀,c(Cr3+)=0.1mol/L,Ksp=c(Cr3+)c3(OH-)=6.0×10-31,c3(OH-)=$\frac{6.0×1{0}^{-31}}{0.1}$=6.0×10-30;c(OH-)=$\root{3}{6}$×10-10mol/L,c(H+)=$\frac{1{0}^{-14}}{\root{3}{6}×1{0}^{-10}}$=$\frac{1{0}^{-14}}{1{0}^{0.3}×1{0}^{-10}}$=10-4.3mol/L,pH=-lgc(H+)=4.3,
则要使Fe3+沉淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是3.2~4.3,
故答案为:3.2~4.3之间;
(3)K2Cr207的溶解度小于Na2Cr207的溶解度,加入固体KCl时:Na2Cr207+2KCl=K2Cr207↓+2NaCl,使K2Cr207超饱和而析出晶体,
故答案为:K2Cr207的溶解度小于Na2Cr207的溶解度,加入固体KCl时使K2Cr207超饱和而析出晶体;
(4)酸性的K2Cr207溶液常用于酒驾的检验,铬元素化合价+6价降低到+3价,碳元素化合价升高从-2价升高为0价,根据质量守恒定律和得失电子守恒原理,反应为:2Cr2072-+3C2H5OH+16H+=4Cr3++3CH3COOH+11H20,Cr2O72-和Cr3+在溶液中分别显橙色和绿色,可利用颜色的变化检验乙醇,即橙色的Cr2O72-在酒精作用下转化为绿色的Cr3+,则能检查司机是否酒后开车,所以反应时可观察到的现象是溶液由橙色变为绿色,
故答案为:2Cr2072-+3C2H5OH+16H+=4Cr3++3CH3COOH+11H20;溶液由橙色变为绿色.
点评 本题考查重铬酸钠的制备实验过程分析,侧重滴定实验的计算,沉淀溶解平衡的溶度积常数计算应用的考查,题目难度较大,注意把握滴定原理以及实验的过程分析,掌握基础和题干信息是关键.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 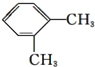 | B. |  | C. |  | D. | 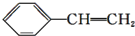 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com