
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
A、 +C2H5Cl→ +C2H5Cl→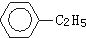 +HCl +HCl |
B、 +C2H5OH→ +C2H5OH→ +H2O +H2O |
C、 +CH2═CH2→ +CH2═CH2→ |
D、 +CH3CH3→ +CH3CH3→ +HCl +HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH6~9 | 0.5mg?L-1 |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基) 、
、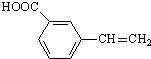 、
、查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ①H2O |
| CO2+H2O |
| ②△ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com