
【题目】在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用![]() 表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:

(1)A、B、C三种物质可以归为一类的依据是_______________________________。
(2)将C归为化合物,将D归为单质的理由是_______________________________。
(3)用化学反应方程式表示为________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)____________ 。
【答案】都含有氧元素 二氧化碳是由不同种原子构成的分子,而氮气是由同种原子构成的分子 2CO+2NO![]() N2+2CO2 15∶22 化学变化中原子的种类、数目、质量没有发生改变(其他合理答案也可)
N2+2CO2 15∶22 化学变化中原子的种类、数目、质量没有发生改变(其他合理答案也可)
【解析】
(1)根据氧化物的概念,由两种元素组成,其中含有氧元素的化合物,可将A、B、C三种物质归为氧化物,则A、B、C三种物质可以归为一类的依据是都含有氧元素。
(2)根据单质(由同种元素组成的物质)、化合物(由不同种元素组成的物质)概念可知将C归为化合物,将D归为单质的理由是二氧化碳是由不同种原子构成的分子,而氮气是由同种原子构成的分子;
(3)根据化学方程式中,物质的系数之比等于其物质的量之比可知,消耗2moLNO就会生成2moLCO2,所以化学变化过程中消耗的A物质和生成的C物质的质量比为15:22;
(4)依据质量守恒定律可得化学变化中原子的种类、数目、质量没有发生改变。


科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应:X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时Y和Z的生成速率之比为2∶3
C. X、Y的转化率之比为1:3
D. c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个可变容积的容器中发生反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时n(A)为________mol。
(2)若开始时放入3molA和3molB,达到平衡后,生成n(C)为________mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别是ymol和3amol,则x=________,y=________。平衡时,n(B)________(填序号)。
A.大于2mol B.等于2mol C.小于2mol D.可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是________。
(5)若保持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。开始时放入1molA和1molB,达到平衡后,生成b molC,将b与a进行比较,则________(填序号)。
A.a<b B.a>b C.a=b D.不能比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
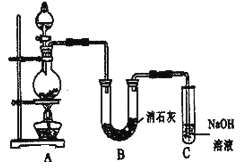
(1)A、B中的反应物分别是浓盐酸和MnO2。写出所发生的化学方程式__________,进入装置C的气体中所含杂质是_____、_____。
(2)漂白粉的有效成分是____(填化学式);D中所发生的化学反应的离子方程式是_______。
(3)此实验所得漂白粉的Ca(ClO)2产率偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是__。②为避免另一副反应的发生,应采取的措施是________。
(4)若将该实验中残留的Cl2,缓慢通入KI溶液至过量,则溶液先变黄后变无色,且可检测到HIO3;写出并配平该“变无色”反应的化学方程式:________,若将KI改为KBr溶液,则溶液变为__色,未检测到HBrO3的存在。由上述事实推测,Cl2、HIO3、HBrO3的氧化性由强到弱的次序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)![]() 2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示。下列说法中不正确的是
2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示。下列说法中不正确的是

A. t0~t1时,v(正)>v(逆)
B. I、Ⅱ两过程分别达到平衡时,A的体积分数Ⅰ=Ⅱ
C. t2 时刻改变的条件可能是向密闭容器中加A物质
D. Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ=Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A. T1>T2 △H > 0
B. 该反应进行到M点放出的热量等于进行到W点放出的热量
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ mol-1
A. 以上三个反应中,只有①是放热反应
B. 反应②的作用是仅为反应③提供还原剂
C. 用这种方法得到的是纯净的锌单质
D. 反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H=![]() kJ mol-1
kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com