
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
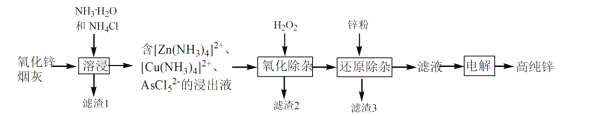
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的____ 性。
(2)滤渣1和滤渣3的主要成份分别是______、______(填化学式)。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是______;“溶浸”时温度不宜过高,其原因是______。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是______。
(5)“电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是______。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_____(写化学式)。该流程中可以循环使用的物质是_____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、 NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与-1gc(Ba2+)的关系如图所示,下列说法不正确的是
与-1gc(Ba2+)的关系如图所示,下列说法不正确的是

A. 该溶液中![]() <
<![]()
B. B、D、E三点对应溶液pH的大小顺序为B>D>E
C. A、B、C三点对应的分散系中,A点的稳定性最差
D. D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO32+)+c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二环[1,1,0]丁烷(![]() )是最简单的桥环化合物。下列关于该化合物的说法错误的是
)是最简单的桥环化合物。下列关于该化合物的说法错误的是
A. 该化合物的二溴代物有4种
B. 每1mol该化合物反应生成1molC4H10需要2molH2
C. 该化合物能够发生取代反应和氧化反应
D. 该化合物中4个碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. NaHSO4在水溶液中的电离方程式:NaHSO4===Na++![]()
B. H2SO3的电离方程式:H2SO3![]() 2H++
2H++![]()
C. CO![]() 的水解方程式:
的水解方程式:![]() +H2O
+H2O![]()
![]() +OH-
+OH-
D. CaCO3的电离方程式:CaCO3![]() Ca2++
Ca2++![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
I.(1)用甲醇制取甲胺的反应为![]() △H
△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=__________kJ·mol-1
Ⅱ.一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应
主反应:![]() △H<0 Ⅰ
△H<0 Ⅰ
副反应:![]() △H<0 Ⅱ
△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)如图所示:
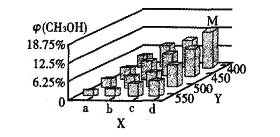
(2)图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是__________
(3)若反应II的平衡常数K值变小.则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动
B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小
D.容器中φ(CH3OCH3)增大
(4)平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为________;用H2表示I的反应速率为______mol·L-1·min-1。反应Ⅱ的平衡常数K=___________(用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量在计算中的应用
(1)有等质量的两气体O3和 O2 ,同温同压下的密度之比为______。
(2)有7.8gNa2R含Na+为0.2mol,则Na2R的摩尔质量为_____,R的相对原子质量为___。
(3)质量比为51:32:34的NH3、CH4、H2S,其物质的量之比为___,它们所含氢原子数之比为__,所含质子数之比为___。
(4)在150°C,m gNH4HCO3固体完全分解生成NH3、CO2、H2O,若所得混合气体对H2的相对密度为d,则用含m、d的代数式表示混合气体的物质的量为_________。
(5)某市售盐酸的质量分数为36.5%,密度为1.18g/cm3,该盐酸的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
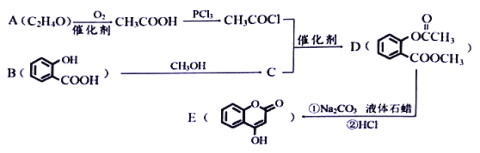
(1)有机物A结构简式为___________。B的名称为___________。
(2)C转化为D的反应类型是___________。
(3)写出E与足量NaOH溶液完全反应的化学方程式___________
(4)1moD完全水解且酸化后,所得有机物与足量 NaHCO3溶液反应生成CO2物质的量为___________。
(5)写出同时满足下列条件的C的同分异构体的结构简式___________。
①苯环上只有两个取代基,且除苯环外无其他环状结构
②核磁共振氢谱只有5个峰
③能与FeCl3溶液发生显色反应
④能水解并能与银氨溶液反应
(6)已知:酚羟基一般不易直接与羧酸酯化,甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。试参照上述合成路线图,写出以苯酚、甲苯为原料制取苯甲酸苯酯(![]() )的合成路线(无机原料任选)___________。
)的合成路线(无机原料任选)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com