
| A. | 若反应物键能之和大于生成物键能之和,则该反应为放热反应 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 因为水分子内存在氢键,所以水的沸点比硫化氢的沸点高 | |
| D. | 需要加热才能发生的化学反应不一定是吸热反应 |
分析 A.若反应物键能之和大于生成物键能之和,则该反应为吸热反应;
B.含有共价键的化合物可能为离子化合物;
C.氢键存在水分子之间,水分子内存在共价键;
D.有的放热反应需要高温条件发生,如铝热反应.
解答 解:A.若反应物键能之和大于生成物键能之和,则该反应为吸热反应,反应物键能之和小于生成物键能之和,则该反应为放热反应,故A错误;
B.含有共价键的化合物可能为离子化合物,可能为共价化合物,若NaOH为离子化合物,H2O为共价化合物,故B错误;
C.氢键存在水分子之间,水分子内存在共价键,故C错误;
D.需要加热才能发生的化学反应不一定是吸热反应,如铝热反应是放热反应,但需要加热,故D正确,
故选D.
点评 本题考查吸热反应与放热反应、化学键、氢键等,比较基础,注意吸热反应与放热反应与反应是否需要加热无关.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 推论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性一般比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与钠反应生成H2 | 可通过加钠观察是否有气泡产生的方法鉴别乙醇的水溶液和乙醛的水溶液 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有物质中都存在化学键 | |
| B. | 离子键在形成过程中一定伴随电子的得失 | |
| C. | 共价化合物中一定含有极性键 | |
| D. | 非极性键只存在于单质分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
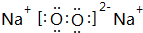 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | NaCl必须保存在棕色瓶中 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com