
��14�֣���һ�ܱ������м���2mol A��0.6molC��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯��ͼһ��ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3-t4��Ϊʹ�ô�����ͼһ��t0-t1��c��B��δ������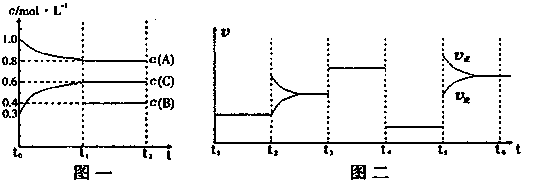
��1����t1=15min����t0-t1����CŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��C��= ��
��2��t4-t5�θı������Ϊ ��B����ʼ���ʵ���Ϊ ��
�÷�Ӧ����ʽ�ɱ�ʾΪ
����ƽ��ʱ��Ӧ��ƽ�ⳣ�����±���ʾ��
| t1��t2 | t2��t3 | t3��t4 | t4��t5 | t5��t6 |
| K1 | K2 | K3 | K4 | K5 |
��1�� 0.02 mol/��L.min��
��2�� ��ѹ����������������� 1mol 2A+B 3C
3C
0.84 = = = <
��3�� a:b="2:1" c ��0
�������������1�����ݷ�Ӧ���ʵļ��㹫ʽ���ɼ����v��C��="0.02" mol/��L.min����ע�ⵥλ����ʡ��
2������ͼ�����Գ���������AΪ��Ӧ��CΪ������ٸ���t4-t5�θı�����������ʶ���С����ƽ��δ�ƶ���˵�����ǽ��£�Ҳ���Ǹı���Ũ�ȣ�����ֻ���ǽ�ѹ�����������С�������ƶϳ��÷�ӦΪ�����������ķ�Ӧ���ɴ˿����������ӦʽΪ 2A+B 3C �����ȸ���C����ʼŨ�������ʵ���������������Ϊ2L������A��Ӧ����0.2*2=0.4mol��B��Ӧ��0.2mol�����Bʣ��0.4*2=0.8mol��������ʼ���ʵ���Ϊ1mol��
3C �����ȸ���C����ʼŨ�������ʵ���������������Ϊ2L������A��Ӧ����0.2*2=0.4mol��B��Ӧ��0.2mol�����Bʣ��0.4*2=0.8mol��������ʼ���ʵ���Ϊ1mol��
����ƽ�ⳣ��=�������Ũ�ȵ���������/��Ӧ���Ũ�ȵ��������ݣ�����ͼ�����Լ���������εķ�Ӧƽ�ⳣ��������Ϊ��Ӧ��ƽ�ⳣ��ֻ���¶��йأ�����Ӧ���¶ȱ��ֲ���ʱ����Ӧ��ƽ�ⳣ�����ֲ��䡣���һ���Σ����£�ʹƽ�����ƣ�����ƽ�ⳣ�����
3�����ݷ�Ӧǰ���������ķ�Ӧ��Ҫ�ﵽ��Чƽ��ֻ��Ҫ��Ӧ���Ũ��֮�ȵ���ԭʼŨ��֮�ȼ��ɣ�����Ҫ�ﵽ��Чƽ��ֻҪa:b="2:1" c ��0
���㣺��ѧ��Ӧ���ʵļ��㣬Ӱ�컯ѧƽ������أ���Чƽ���������
�����������Ѷ����У���Ҫ�����˻�ѧƽ����жϼ����㣬����ƽ�ⳣ��ֻ���¶��йؼ���Чƽ��������ǽ���Ĺؼ��������Ҫ��ϸ��ͼ������ͼ��ĺ������꣬��Ҫ����ͼ����Ϣ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪298Kʱ��Ӧ2SO2( g ) + O2( g ) ![]() 2SO3( g )����H = -197 kJ �� mol-1 ������ͬ�¶�����һ�ܱ������м���2 mol SO2��1 molO2 ���ﻯѧƽ��ʱ�ų�����Ϊa1 kJ ������һ�ݻ���ͬ���ܱ�������ͨ�� 1 mol SO2��0.5 molO2 ���ﻯѧƽ��ʱ�ų�����Ϊa2 kJ ,�����й�ϵʽ����ȷ���ǣ� ��
2SO3( g )����H = -197 kJ �� mol-1 ������ͬ�¶�����һ�ܱ������м���2 mol SO2��1 molO2 ���ﻯѧƽ��ʱ�ų�����Ϊa1 kJ ������һ�ݻ���ͬ���ܱ�������ͨ�� 1 mol SO2��0.5 molO2 ���ﻯѧƽ��ʱ�ų�����Ϊa2 kJ ,�����й�ϵʽ����ȷ���ǣ� ��
A��2a2 ��a1�� 197
B��2a2 ��a1����197
C��2a2 = a1����197
D��2a2 = a1��= 197
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��һ��������2SO2��g��+O2��g��![]() 2SO3��g����H=Q kJ��mol-1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%����HΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��Ħ�HΪQ2�������й�ϵ��ȷ���ǣ� ��
2SO3��g����H=Q kJ��mol-1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%����HΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��Ħ�HΪQ2�������й�ϵ��ȷ���ǣ� ��
A.Q��Q1��Q2 B.Q2��Q1��Q C.Q1��Q��Q2 D.Q1=Q2��Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ�����ص���ѧ��������ѧ�ȣ�������ѧ������������ѧ�Ծ����������� ���ͣ���ѡ��
��֪��һ��������2SO2(g)��O2(g) 2SO3(g)����H����Q kJ��mol��1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ����(����)
2SO3(g)����H����Q kJ��mol��1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ����(����)
| A��Q>Q1>Q2 | B��Q1>Q2>Q | C��Q1>Q>Q2 | D��Q1��Q2>Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ��������ѧ�ȣ�������ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��һ��������2SO2(g)��O2(g) 2SO3(g)����H����Q kJ��mol��1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ����(����)
2SO3(g)����H����Q kJ��mol��1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ����(����)
A��Q>Q1>Q2 B��Q1>Q2>Q C��Q1>Q>Q2 D��Q1��Q2>Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ���ѡ��
[ ]
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com