
| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
分析 由信息可知,发生Cl2+2NaOH=NaClO+NaCl+H2O,3Cl2+6NaOH(热)=NaClO3+5NaCl+3H2O,令溶液中NaClO与NaClO3的物质的量分别为6mol、1mol,根据电子注意守恒计算NaCl的物质的量,以此来解答.
解答 解:由信息可知,发生Cl2+2NaOH=NaClO+NaCl+H2O,3Cl2+6NaOH(热)=NaClO3+5NaCl+3H2O,令溶液中NaClO与NaClO3的物质的量分别为6mol、1mol,
由电子守恒可知,6mol×(1-0)+1mol×(5-0)=n(NaCl)×[0-(-1)],
解得n(NaCl)=11mol,所以该溶液中NaCl与NaClO的物质的量之比为11mol:6mol=11:6,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W | G | |
| A. | 离子半径:T<W<G | |
| B. | 最简单气态氢化物的热稳定性:Q<R | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>G | |
| D. | T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
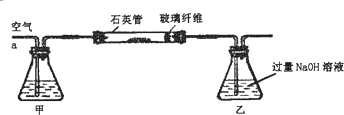
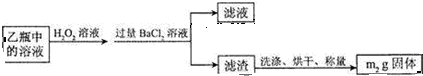
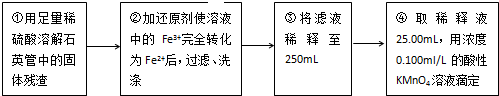
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | SO2和Na2SO3溶液都能使氯水褪色 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | 硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com