
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的物质的量甲<乙 | ||
| C. | 平均反应速度:乙>甲 | D. | 平衡时A的物质的量甲>乙 |
分析 甲为恒容,乙为恒压,随着反应的进行,甲容器压强逐渐增大,而增大压强,平衡向逆方向移动,而乙容器中压强不变,甲与乙容器相比,甲中反应速率较大、平衡向着逆向移动,以此解答该题.
解答 解:甲为恒容,乙为恒压,随着反应的进行,甲容器压强逐渐增大,而乙压强不变,
A.增大压强平衡向逆方向移动,C的转化率减小,则平衡时C的转化率:乙>甲,故A正确;
B.增大压强平衡向逆方向移动,平衡时C的物质的量:甲>乙,故B错误;
C.压强越大反应速率越大,则反应速率:甲>乙,故C错误;
D.增大压强平衡向逆方向移动,则平衡时A的物质的量:乙>甲,故D错误.
故选A.
点评 本题考查化学平衡及其影响因素,为高频考点,题目难度不大,本题注意从压强对平衡移动的影响的角度比较甲乙两个状态,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用向上排空气法收集Na2SO3与浓硫酸反应生成SO2 | |
| B. | 用50mL量筒准确量取25.00mL NaOH溶液 | |
| C. | 除去乙酸乙酯中溶解解的乙酸,加NaOH溶液充分振荡、分液 | |
| D. | 向含有CuCl2的FeC13溶液中加足量铁粉搅拌、过滤,得到纯净FeCl3溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
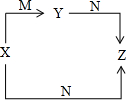 X.Y、Z、M、N五种物质中,X、Y、Z中均含有钠元素,X和M都是常见的单质,N是水,它们之间具有如图所示的转化关系.下列有关物质的推断不正确的是( )
X.Y、Z、M、N五种物质中,X、Y、Z中均含有钠元素,X和M都是常见的单质,N是水,它们之间具有如图所示的转化关系.下列有关物质的推断不正确的是( )| A. | X只是钠 | B. | Y只是Na2O | C. | Z只是NaOH | D. | M可能是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO | H2O | H2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | |
| B. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| C. | ⅠA金属元素是同周期中金属性最强的元素 | |
| D. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com