
分析 (1)铝与盐酸反应生成氯化铝与氢气,镁与盐酸反应生成氯化镁与氢气;令合金中Mg、Al的物质的量分别为xmol、ymol,用x、y表示出各自生成的氢气,利用二者质量之和为3.9g,列方程可以计算出x、y的值,可以测量测定出镁的质量分数.
(2)铝与氢氧化钠反应溶解,镁不能与氢氧化钠反应,故可以加入氢氧化钠溶液,剩余的固体为Mg,Mg的质量除以总质量可得合金中Mg的质量分数.
(3)由转化关系可知,最后的沉淀是氢氧化镁,分离固体与溶液常用的分离方法是过滤;
根据氢氧化镁的质量计算合金中Mg的质量,再利用质量分数的定义计算合金中Mg的质量分数;
未洗涤沉淀,氢氧化镁沉淀附着其它物质,使测定的氢氧化镁的质量增大,导致测定合金中Mg的质量增大.
解答 解:(1)铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+═2Al3++3H2↑,镁与盐酸反应生成氯化镁与氢气,反应离子方程式为Mg+2H+═Mg2++H2↑;
令合金中Mg、Al的物质的量分别为xmol、ymol,用x、y表示出各自生成的氢气,利用二者质量之和为3.9g,列方程可以计算出x、y的值,可以测量测定出镁的质量分数,
故答案为:能;
(2)铝与氢氧化钠反应溶解,镁不能与氢氧化钠反应,故可以加入氢氧化钠溶液,铝和氢氧化钠溶液反应生成四羟基合铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,剩余的固体为Mg,故得合金中Mg的质量分数为$\frac{ag}{3.9g}$×100%,
故答案为:NaOH溶液;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;$\frac{ag}{3.9g}$×100%,;
(3)由转化关系可知,最后的沉淀是氢氧化镁,分离固体与溶液常用的分离方法是过滤;
氢氧化镁的质量是2.9g,根据镁元素守恒可知合金中Mg的质量为2.9g×$\frac{24}{58}$=1.2g,所以合金中Mg的质量分数为$\frac{1.2g}{3.9g}$×100%=30.8%;
未洗涤沉淀,氢氧化镁沉淀附着其它物质,使测定的氢氧化镁的质量增大,导致测定合金中Mg的质量增大,测定的合金中镁的质量分数偏大,
故答案为:过滤;30.8%;偏大.
点评 本题考查镁和铝的化学性质、化学实验方案的设计,物质含量测定、化学计算等,难度中等,掌握镁和铝的化学性质是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 在一个U形管里盛有氯化铜溶液,并插入Zn片和C棒作电极,按下图连接.
在一个U形管里盛有氯化铜溶液,并插入Zn片和C棒作电极,按下图连接.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
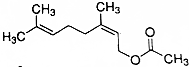 某酯是一种食用香料,其结构简式如图所示,有关该酯叙述正确的是( )
某酯是一种食用香料,其结构简式如图所示,有关该酯叙述正确的是( )| A. | 分子式为C12H18O2 | |
| B. | 能发生加成反应、取代反应和消去反应 | |
| C. | 能使酸性KMn04溶液和溴水褪色,且褪色原理相同 | |
| D. | 1mol该有机物在一定条件下和H2反应,共消耗H2为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
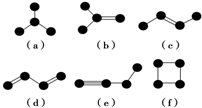 如图是由4个碳原子结合成的6种有机物(氢原子没有画出).
如图是由4个碳原子结合成的6种有机物(氢原子没有画出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
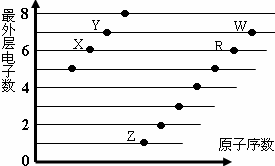
| A. | 元素非金属性:X>R>W | |
| B. | X与R形成的分子内含两种作用力 | |
| C. | X、Z形成的化合物中可能含有共价键 | |
| D. | 元素对应的离子半径:W>R>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com