
将2mol SO2和2mol SO3气体混合于固定容积的容器内,在一定条件下,发生反应:
2SO2 + O2 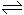 2SO3,达平衡时SO3为n mol。相同温度下分别按下列配比,平衡后SO3的物质的量大于n mol的是
2SO3,达平衡时SO3为n mol。相同温度下分别按下列配比,平衡后SO3的物质的量大于n mol的是
A.2mol SO2和1mol O2 B.2mol SO2和1mol O2和2mol SO3
C.4mol SO2和1mol O2 D.3mol SO2和0.5mol O2和1mol SO3
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
CaSO4有很多用途,例如制豆腐就用到石膏(主要成分是CaSO4)。CaSO4微溶于水,溶于水的部分可以形成CaSO4饱和溶液,其饱和溶液中存在平衡:
CaSO4(s)  Ca2+(aq)+SO
Ca2+(aq)+SO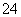 (aq),分别采取下列措施,能使溶液中c(Ca2+)增大的是
(aq),分别采取下列措施,能使溶液中c(Ca2+)增大的是
A.降温 B.加入CaSO4 C.加入BaCl2 D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,[Ag+]=[Cl-],且Ag+和Cl-浓度的乘积等于1.8×10-10mol2·L-2
C.温度一定时,在AgCl饱和溶液中,Ag+和Cl-浓度的乘积是一个常数
D.向饱和AgCl溶液中加入盐酸,Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 ___ _____(填字母)。
(3) 常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
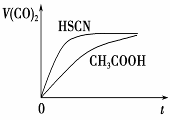 (4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
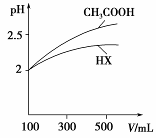 (5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),
c(CH3COO-)/c(CH3COOH)=________。
(7) 写出少量CO2通入次氯酸钠溶液中的离子方程式:
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图像描述正确的是
A.由图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)正反应是放热反应
2AB3(g)正反应是放热反应
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.图④表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化

查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如
下反应:3A(g)+B(g)  xC(g)+D(s),向甲中通入6molA和2 molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,下列叙述中不正确的是
xC(g)+D(s),向甲中通入6molA和2 molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,下列叙述中不正确的是
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B.平衡时,甲、乙两容器中A、B的物质的量之比相等
C.平衡时甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8:5
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1 mol CO2中含有________mol C和________mol O;
(2)1.80 mol CO2中含有________个CO2分子,________个C原子,________个O原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
将11.5 g钠投入到89 g水中(足量),充分反应后所得溶液的密度为1.25 g·cm-3。计算:
(1)生成H2的体积(标准状况下)。
(2)所得溶液中溶质的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com