
分析 计算硫酸铜晶体物质的量,溶于水现场硫酸铜溶液中溶质为硫酸铜,c=$\frac{n}{V}$;取其溶液100mL浓度不变,向其中加入100mL 0.2 mol•L-1的NaOH溶液,物质的量n=0.1L×0.2 mol•L-1=0.02mol,发生反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,反应后得到溶液硫酸钠,计算溶液浓度.
解答 解:将25g硫酸铜晶体物质的量=$\frac{25g}{250g/mol}$=0.1mol,溶解于水中,配成1L溶液,此溶液的物质的量浓度=$\frac{0.1mol}{1L}$=0.1mol/L,
取其溶液100mL浓度为0.1mol,溶液中溶质硫酸铜物质的量=0.1mol×0.1L=0.01mol,向其中加入100mL 0.2 mol•L-1的NaOH溶液,物质的量n=0.1L×0.2 mol•L-1=0.02mol,发生反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,二者恰好反应,反应后得到硫酸钠溶液,硫酸钠物质的量为0.01mol,混合后溶液体积不变为200ml,则硫酸钠溶液浓度=$\frac{0.01mol}{0.2L}$=0.05mol/L,
答:将25g硫酸铜晶体溶解于水中,配成1L溶液,此溶液的物质的量浓度是0.1mol/L,取其溶液100mL,向其中加入100mL 0.2 mol•L-1的NaOH溶液,反应后溶液的物质的量浓度0.05mol/L.
点评 本题考查化学反应的计算,为高考常见题型,把握发生的反应及物质的量关系为解答的关键,侧重于学生的分析能力和计算能力的考查,注意溶液体积的计算,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 | |
| B. | 将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 | |
| C. | 测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | 0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,Zn板应与外接电源的负极相连 | |
| B. | 放电时,溶液中的OH从正极向负极移动 | |
| C. | 正极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OH- | |
| D. | 充电时,当转移0.2mol电子时,阴极质量增加3.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
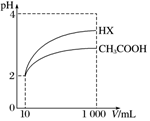 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由W和X两种元素形成的化合物可能含有非极性共价键 | |
| B. | 由X、Y、Z三种元素形成的化合物只能为Y2ZX2或Y2ZX4 | |
| C. | 由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性 | |
| D. | W、X、Y、Z四种元素两两之间形成二元化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法 | |
| B. | KNO3溶液和CH3OONH4溶液均显中性.两溶液中水的电离程度相等 | |
| C. | 若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| D. | 用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com