


分析 (1)根据信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成;
(2)①Cu能与氧气反应,硅胶具有吸水性;
②控制氮气的流速是防止温度过高,体系中要通入适量的氢气可将氧气转化为水蒸气;
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1.
解答 解:(1)由信息:四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,方程式为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
(2)①Cu能与氧气反应,则Cu屑的作用为除去原料气中的氧气;硅胶具有吸水性,可除去生成的水蒸气,
故答案为:除去原料气中的氧气;除去生成的水蒸气;
②氮化炉中3SiO2(s)+2N2(g)=Si3N4(s)△H=-727.5kJ/mol,该反应为放热反应,开始时严格控制氮气的流速以控制温度是防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;体系中要通入适量的氢气是为将体系中的氧气转化为水蒸气,而易被除去(或整个体系中空气排尽),
故答案为:该反应为放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触;将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽);
③氮化硅能与HF酸反应,盐酸、稀硫酸均不与Cu反应,氮化硅中混有铜粉,为除去混有的Cu,可选择硝酸,Cu与硝酸反应,而氮化硅与硝酸不反应,
故答案为:硝酸;
(3)①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,
故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1,补充HCl与H2的物质的量之比为≈5:1.
故答案为:5:1.
点评 本题考查氮化硅的制备实验方案的设计,明确制备实验的装置中各部分的作用及物质的性质是解答本题的关键,注意物质的特性即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
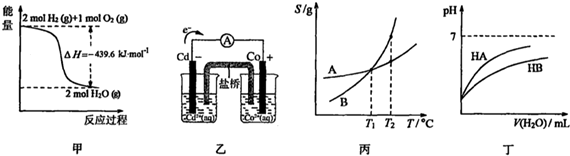
| A. | 由甲可知:氢气的燃烧热为219.8kJ/mol | |
| B. | 由乙可知:盐桥中的Cl-向Cd电极移动 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数:A=B | |
| D. | 由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其PH:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.5mol•L-1H2SO4溶液 | B. | 35mL 0.6mol•L-1 Al2(SO4)3溶液 | ||
| C. | 70mL 0.8 mol•L-1NaCl溶液 | D. | 60mL 0.7 mol•L-1 Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通入过量的氢氧化钠溶液:CO2+2OH-═CO32-+H2O | |
| B. | 碳酸钙与硝酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 少量金属钠放入冷水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 增大压强可以提高HCl转化率 | |
| D. | 平衡常数K(200℃)<K(400℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com