

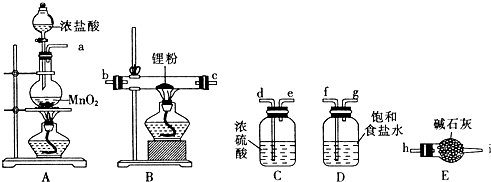
分析 本题是利用双氧水的分解产生O2,再根据塑料燃烧产物来验证其组成的,过氧化氢中加入二氧化锰催化反应分解生成水和氧气,通过浓硫酸干燥后通入装置C加热反应生成的气体通过装置D中浓硫酸干燥后通过澄清石灰水检验生成的气体二氧化碳,最后装置F中的碱石灰防止空气中的二氧化碳进入装置E干扰测定结果,
(1)双氧水在二氧化锰的催化作用下分解得到氧气
(2)仪器B 中装有浓硫酸,具有吸水性,可干燥氧气
(3)仪器E中有澄清石灰水,而二氧化碳能使澄清石灰水变浑浊
(4)可根据元素守恒,水是塑料的燃烧产物,水中的H元素和塑料中H元素质量相同
(5)若装置中没有连接仪器B,在A装置中的水会在D中和反应生成的水一起被吸收,使水质量增大
解答 解:(1)双氧水分解得到氧气和水,化学方程式为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑
(2)浓硫酸具有吸水性,仪器B的作用是吸收气体中的水蒸气,干燥氧气,故答案为:干燥氧气(或吸收水分)
(3)塑料燃烧产物中 含有二氧化碳,二氧化碳能使澄清石灰水变浑浊,
故答案为:澄清石灰水变浑浊;
(4)若装置C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重ag为水的质量,由元素守恒,塑料中H元素的质量为:a×$\frac{2}{18}$×100%=$\frac{a}{9}$,
故答案为:$\frac{a}{9}$;
(5)若装置中没有连接仪器B,没有干燥氧气,使水在D中吸收的质量增大,使该塑料试样中氢元素的质量测算结果偏大,
故答案为:偏大.
点评 本实验题要利用元素守恒的思想,还要特别注意在验证生成物水时要排除从溶液中携带的水的干扰,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应 | B. | 化合反应 | C. | 分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把分别盛有甲、乙、丙气体的试管到插入盛有水的烧杯中,一段时间后,观察到如图所示的现象,对甲、乙、丙气体的分析正确的是( )
把分别盛有甲、乙、丙气体的试管到插入盛有水的烧杯中,一段时间后,观察到如图所示的现象,对甲、乙、丙气体的分析正确的是( )| A. | 甲、乙、丙气体都易溶于水 | B. | 乙气体比甲气体更易溶于水 | ||
| C. | 可以采用排水集气方法收集丙气体 | D. | 不可以用排空气法收集甲气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 保持容器容积和温度不变,向其中加入1molH2,则v(I2)增大 | |
| B. | 保持容器容积和温度不变,向其中加入1molAr(Ar不参与反应),则v(I2)减小 | |
| C. | 保持容器压强和温度不变,向其中加入11molAr(Ar不参与反应),则v(H2)减小 | |
| D. | 保持容器压强和温度不变,向其中加入1molH2(g)和1molI2(g),则v(H2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CH2=CH-CH3 | B. | CH2=CH-CH2-CH3 | C. | CH3-CH=CH-CH3 | D. | CH2=CH-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤③① | B. | ①③ | C. | ②④⑤① | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com