
有—处于平衡状态的反应: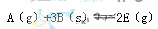 ,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E
,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E
分离除去 ( )
A.①③⑥ B.②③⑥ C.②④⑥ D.②④⑤⑥
科目:高中化学 来源: 题型:
 为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:| 78y |
| 53x+25y |
| 78y |
| 53x+25y |
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:013
|
下列说法正确的是 | |
| [ ] | |
A. |
在高温下,将氯化铵晶体加入处于平衡状态的合成氨反应时,平衡不发生移动 |
B. |
在密闭容器中,当CaCO3 |
C. |
有固体参加的可逆反应达平衡后,若改变压强,不会影响平衡的移动 |
D. |
在合成氨反应中,使用催化剂能提高反应速率,使氨的质量分数增加,从而增加氨的产量 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省稳派名校学术联盟高三12月调研考试理综化学试卷(解析版) 题型:填空题
氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应可生成氨气:

该反应在固定体积的密闭容器中进行,有关说法正确的是_____________(填序号字母)。
A.反应处于平衡状态时,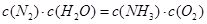
B.反应达到平衡后,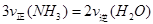
C.体系的总压强不变,说明反应已达平衡
D.混合气体的密度保持不变,说明反应已达平衡
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
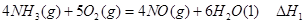 ①
①
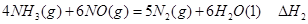 ②
②
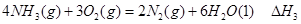 ③
③
请写出上述三个反应中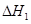 、
、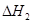 、
、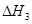 三者之间关系的表达式,
三者之间关系的表达式,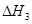 =_________。
=_________。
(3)工业制硝酸的主要反应是:
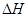 =
=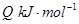
①升高温度,反应的K值减小,则Q______(填“>”、“<”或“=”)0。
②若反应起始的物质的量相同,下列关系图错误的是________(填序号)。


③在容积固定的密闭容器中发生上述反应,容器内部分物质的浓度如下表:
|
时间/浓度 |
|
|
|
|
|
起始 |
4.0 |
5.5 |
0 |
0 |
|
第2min |
3.2 |
a |
0.8 |
1.2 |
|
第4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
第6min |
2.0 |
3.0 |
2.0 |
3.0 |
反应在第2 min到第4 min时,O2的平均反应速率为________。
反应在第2 min时改变了条件,改变的条件可能是______________________________。
该条件下,反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积为5 L的密闭容器内,加入
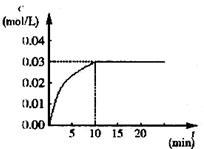 0.3 mol的CO和0.3 mol的H2O,在催化剂存
0.3 mol的CO和0.3 mol的H2O,在催化剂存
在和800℃的条件下加热,发生如下反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反
CO2(g)+H2(g) ΔH>0,反
应中CO2的浓度随时间变化情况如右图:
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com