
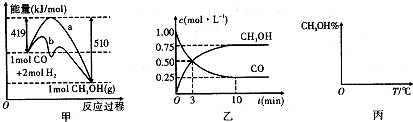
| n(CH3OH) |
| n(CO) |
| 1-0.25 |
| 10 |
| 1-0.25 |
| 10 |
| 0.75 |
| 0.25×(0.5)2 |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、元素W、R的简单离子的电子层结构不同 |
| B、W、R二种元素形成的化合物中可能含有共价键 |
| C、由X、Z、W三种元素形成的化合物,其水溶液一定显酸性 |
| D、含有X、Y、Z、W四种元素的化合物一定是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、由C(金刚石)→C(石墨)△H═-1.9kJ/mol 可知,金刚石比石墨稳定 |
| C、由2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1可知,H2的燃烧热为-571.6kJ?mol-1 |
| D、稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-53.7KJ/mol,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B、0.1mol?L-1 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
| C、pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D、常温下,浓度为0.1mol?L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com