
����ʱ�����й��ڵ������Һ��������ȷ���� ( )
A��ϡ��pH=10�İ�ˮ����Һ���������ӵ�Ũ�Ⱦ�����
B�����������ʵ���Ũ����ȵĢ�(NH4)2CO3����NH4A1(SO4)2����(NH4)2Fe(SO4)2������Һ��c(NH4+)����>��>��
C��pH=ll��NaOH��pH=ll�İ�ˮ�ֱ�ϡ��100�����pHǰ��һ�����ں���
D���ֱ��к�pH���������ͬ������ʹ��ᣬ���������������Ƶ����ʵ�����
 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ���ữѧʽ | HClO | H2CO3 |
| ����ƽ�ⳣ�� | K=4.7��10-8 | K1=4.3��10-7��K2=5.6��10-11 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ����ĺϳɺ�Ӧ���ǵ�ǰ����Ҫ�о�����֮һ��
(1)һ�������£���һ���ܱ������г������壺N2 2mol��H2 6mol����ƽ���N2��ת����Ϊ50%��ͬʱ����92.3KJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��______________________________��
(2)��ͳ�������ϳɰ���������صķ�ӦʽΪ��N2+3H22NH3 ��
�ٸ÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��K=______________�������¶ȣ�Kֵ______���������С�����䡱����
�ڲ�ͬ�¶ȡ�ѹǿ�£��ϳɰ�ƽ����ϵ��NH3�����ʵ����������±���N2��H2����ʼ���ʵ���֮��Ϊ1��3���������������ݣ� �����¶Ⱥ�ѹǿ����ʱH2ת������ߣ�ʵ�ʹ�ҵ�����в�ѡ�ø���������Ҫԭ���� ��
�����й��ںϳɰ�˵����ȷ�� ������ĸ��
A��ʹ�ô���������ߵ�����ת����
B��Ѱ�ҳ����µĺ��ʴ�����δ���о��ķ���
C�����ڦ�H<0����S>0���ʺϳɰ���Ӧһ�����Է�����
(3)�������Simons�ȿ�ѧ�ҷ����˲���ʹ�����ѻ�Ϊ��Ϳ�ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò�����Ϊ�缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ�백�������ط�ӦΪ4NH3+3O2=2N2+6H2O������Ϊ�������ҺӦ�� ��(����ԡ���������"�������ԡ�)��д�������缫��Ӧʽ ��
(4)��ҵ�Ͼ�����������Ⱦ����֮һ�ǣ�����K2Cr2O7���Է�ˮ��������ڣ�����������NaCl����Fe��ʯīΪ�缫���е�⡣����һ��ʱ�������Cr(OH)3��Fe(OH)3������ȥ����֪Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31����
��֪�������Һ��c(Fe3+)Ϊ2.0��10-13mol/L������Һ��c(Cr3+)Ϊ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ɽ��ʡɽ���и���3���¿����۲��֣��������� ���ͣ������
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ����ĺϳɺ�Ӧ���ǵ�ǰ����Ҫ�о�����֮һ��
(1)һ�������£���һ���ܱ������г������壺N2 2mol��H2 6mol����ƽ���N2��ת����Ϊ50%��ͬʱ����92.3KJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��______________________________��
(2)��ͳ�������ϳɰ���������صķ�ӦʽΪ��N2+3H2 2NH3��
2NH3��
�ٸ÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��K=______________�������¶ȣ�Kֵ______���������С�����䡱����
�ڲ�ͬ�¶ȡ�ѹǿ�£��ϳɰ�ƽ����ϵ��NH3�����ʵ����������±���N2��H2����ʼ���ʵ���֮��Ϊ1��3���������������ݣ� �����¶Ⱥ�ѹǿ����ʱH2ת������ߣ�ʵ�ʹ�ҵ�����в�ѡ�ø���������Ҫԭ���� ��
�����й��ںϳɰ�˵����ȷ�� ������ĸ��
A��ʹ�ô���������ߵ�����ת����
B��Ѱ�ҳ����µĺ��ʴ�����δ���о��ķ���
C�����ڦ�H<0����S>0���ʺϳɰ���Ӧһ�����Է�����
(3)�������Simons�ȿ�ѧ�ҷ����˲���ʹ�����ѻ�Ϊ��Ϳ�ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò�����Ϊ�缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ�백�������ط�ӦΪ4NH3+3O2=2N2+6H2O������Ϊ�������ҺӦ�� ��(����ԡ���������"�������ԡ�)��д�������缫��Ӧʽ ��
(4)��ҵ�Ͼ�����������Ⱦ����֮һ�ǣ�����K2Cr2O7���Է�ˮ��������ڣ�����������NaCl����Fe��ʯīΪ�缫���е�⡣����һ��ʱ�������Cr(OH)3��Fe(OH)3������ȥ����֪Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31����
��֪�������Һ��c(Fe3+)Ϊ2.0��10-13mol/L������Һ��c(Cr3+)Ϊ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ����3���¿����۲��֣������棩 ���ͣ������
��16�֣�����һ����Ҫ�Ļ���ԭ�ϣ����ĺϳɺ�Ӧ���ǵ�ǰ����Ҫ�о�����֮һ��
(1)һ�������£���һ���ܱ������г������壺N2 2mol��H2 6mol����ƽ���N2��ת����Ϊ50%��ͬʱ����92.3KJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��______________________________��
(2)��ͳ�������ϳɰ���������صķ�ӦʽΪ��N2+3H2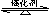 2NH3 ��
2NH3 ��
�ٸ÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��K=______________�������¶ȣ�Kֵ______���������С�����䡱����
�ڲ�ͬ�¶ȡ�ѹǿ�£��ϳɰ�ƽ����ϵ��NH3�����ʵ����������±���N2��H2����ʼ���ʵ���֮��Ϊ1��3���������������ݣ� �����¶Ⱥ�ѹǿ����ʱH2ת������ߣ�ʵ�ʹ�ҵ�����в�ѡ�ø���������Ҫԭ���� ��

�����й��ںϳɰ�˵����ȷ�� ������ĸ��
A��ʹ�ô���������ߵ�����ת����
B��Ѱ�ҳ����µĺ��ʴ�����δ���о��ķ���
C�����ڦ�H<0����S>0���ʺϳɰ���Ӧһ�����Է�����
(3)�������Simons�ȿ�ѧ�ҷ����˲���ʹ�����ѻ�Ϊ��Ϳ�ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò�����Ϊ�缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ�백�������ط�ӦΪ4NH3+3O2=2N2+6H2O������Ϊ�������ҺӦ�� ��(����ԡ���������"�������ԡ�)��д�������缫��Ӧʽ ��
(4)��ҵ�Ͼ�����������Ⱦ����֮һ�ǣ�����K2Cr2O7���Է�ˮ��������ڣ�����������NaCl����Fe��ʯīΪ�缫���е�⡣����һ��ʱ�������Cr(OH)3��Fe(OH)3������ȥ����֪Ksp[Fe(OH)3]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31����
��֪�������Һ��c(Fe3+)Ϊ2.0��10-13mol/L������Һ��c(Cr3+)Ϊ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���ữѧʽ | HClO | H2CO3 |
| ����ƽ�ⳣ�� | K=4.7��10-8 | K1=4.3��10-7��K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com