
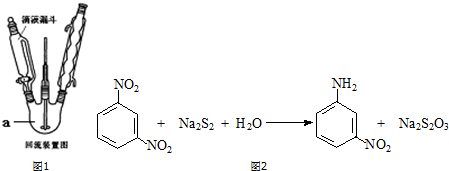
分析 (1)装置a名称为三颈烧瓶;
(2)滤饼洗涤三次,洗去表面的杂质,根据信息知间硝基苯胺微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇,所以选择冷水洗涤,第⑥步产物要进行重结晶,需将粗产品溶解,用热水,不能用有机物,不便于重结晶;
(3)蒸发过程中会析出溶解度随温度升高而降低(或影响不大)的物质,而间硝基苯胺随温度升高溶解度增大,第④步中趁热过滤的目的是滤去杂质,防止目标产物遇冷析出,以免影响产量;
(4)有机分子去氧加氢为还原反应,根据题干信息铁和盐酸作用制得初生态氢原子(还原性远强于碱金属多硫化物),还原性强,不具有选择性,未必能将硝基还原为氨基,得不到想要的产品;
(5)间硝基苯胺为有机物,微溶于水,第④步用盐酸溶解粗产品,间硝基苯胺可与盐酸作用可以形成盐溶于水中.
解答 解:(1)装置a名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)间硝基苯胺微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇,所以选择冷水洗涤第③步中滤饼三次,二次结晶也就是重结晶,可提纯晶体,间硝基苯胺溶于乙醇、乙醚、甲醇,不便于重结晶,用热水,通过温度调节,可用降温结晶提纯晶体,所以选择热水,
故答案为:A;B;
(3)蒸发过程中会析出溶解度随温度升高而降低(或影响不大)的物质,而间硝基苯胺随温度升高溶解度增大,第④步中趁热过滤的目的是滤去杂质,防止目标产物遇冷析出,以免影响产量,
故答案为:滤去杂质,防止目标产物遇冷析出,以免影响产量;
(4)间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,铁和盐酸作用制得初生态氢原子(还原性远强于碱金属多硫化物),还原性强,不具有选择性,未必能将硝基还原为氨基,得不到想要的产品,所以不选,
故答案为:铁和盐酸作用还原性强,不具有选择性;
(5)第④步用盐酸溶解粗产品,是因为间硝基苯胺可与盐酸作用可以形成盐溶于水中,不用水的原因是间硝基苯胺微溶于水,
故答案为:间硝基苯胺微溶于水,但可与盐酸作用可以形成盐溶于水中.
点评 本题考查间硝基苯胺制备实验方案,题目难度中等,涉及物质的分离提纯、对装置与操作的分析等,明确原理是解题关键,需要学生具备扎实的基础,有机化学实验在中学化学中较少,学生较陌生,导致感觉解答问题较生疏,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 溶液pH不断增大,最后为7 | B. | 阳极先析出Cl2,后析出O2 | ||
| C. | 阴极始终只析出H2 | D. | 电解最后阶段为电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
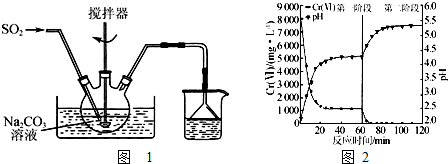
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的球棍模型为: | B. | 次氯酸的结构式为:H一C1一O | ||
| C. | 淀粉的结构简式为:[C6H12O6]n | D. | 乙烯的电子式为: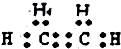 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3-→NaOH | B. | CaCO3-→Ca(OH)2 | C. | NaNO3-→NaCl | D. | CuO-→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH(CH2)2CH3 | B. | CH2=CH(CH2)3CH3 | ||
| C. | CH3CH=CHCH=CHCH3 | D. | CH3CH2CH=CHCH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com