
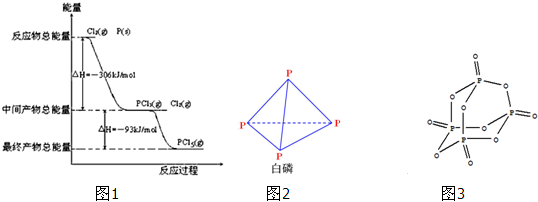
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ?mol-1) | 198 | 360 | 498 | x |
| 3 |
| 2 |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③⑥ |
| C、①②④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
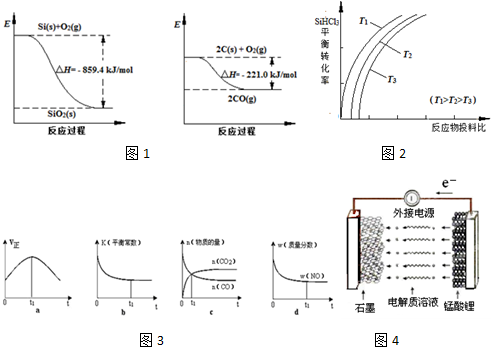
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
| 催化剂 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
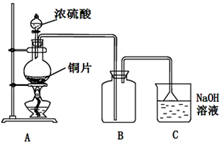
 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O)
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 溶液变成黄色 |
| 步骤2: |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) |
改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
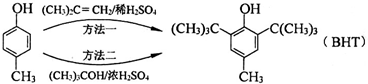
A、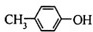 与BHT为同系物 与BHT为同系物 |
B、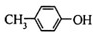 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com