
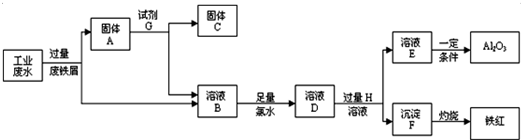
分析 (1)某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,所以所得固体包括Fe和Cu;
(2)根据工业废水中加入铁以后发生的反应来确定溶液中的离子;
(3)过滤所得溶液B中含有Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,生成+3价的铁离子,2Fe2++Cl2=2Fe3++2Cl-,1mol氯气参加反应转移2mol电子;检验Fe3+ 的方法是加KSCN溶液,溶液变红;D→E是铝离子生成氢氧化铝沉淀,以及氢氧化铝溶解在碱中的离子反应,据此分析解答;
(4)金属铁可以和盐酸、稀硫酸之间反应,但是金属铜和稀盐酸、稀硫酸之间不反应,据此实现金属铁和铜的分离,铝离子可以和氢氧根离子之间反应生成可溶溶液,可以实现铝离子和亚铁离子的分离.
解答 解:(1)根据流程图中可以知道,完成回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,
故答案为:Fe、Cu;
(2)金属铁可以和铁离子、铜离子之间反应,过滤所得溶液B中含有Al3+、Fe2+,故答案为:Fe2+、Al3+(H+);
(3)过滤所得溶液B中含有Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-;该反应中氯气中氯元素从0价变为产物中的氯离子,化合价降低是氧化剂,加碱先发生反应Al3++3OH-=Al(OH)3↓,强碱过量Al(OH)3+OH-=AlO2-+2H2O,总反应为:Al3++4OH-=AlO2-+2H2O,
故答案为:2Fe2++Cl2=2Fe3++2Clˉ;Al3++4OH-=AlO2-+2H2O;
(4)金属铁可以和盐酸、稀硫酸之间反应,但是金属铜和稀盐酸、稀硫酸之间不反应,据此实现金属铁和铜的分离,所以试剂G是稀盐酸或是稀硫酸,分离Al3+、Fe2+,需加强碱,氢氧化铝既可以和强酸反应还可以和强碱反应,溶液E焰色反应呈紫色(透过蓝色钴玻璃),说明含有钾离子,说明试剂H是氢氧化钾;
故答案为:稀盐酸或稀硫酸、KOH.
点评 本题以工业废水中回收铁红、Al2O3和金属Cu考查了物质的分离和提纯,注意根据物质的性质选择分离提纯的方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
. .
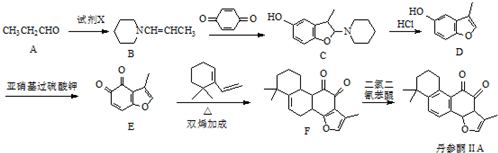
. 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ | |
| C. | 硫化钠溶液显碱性:S2-+2H2O═H2S+2OH- | |
| D. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-、SO42-、NH4+、Mg2+ | B. | Cu2+、Mg2+、Cl-、SO42- | ||
| C. | H+、K+、OH-、NO3- | D. | Ag+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
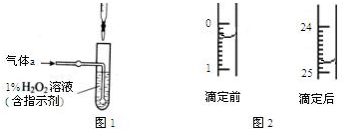
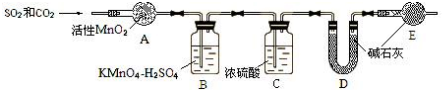
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴易挥发,实验室保存液溴时要密封保存,且加少量水进行液封 | |
| B. | 氯化钠中混有少量单质碘杂质,可用升华的方法提纯 | |
| C. | 保存FeCl2溶液时,通常在溶液中加少量的单质铁 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,要将NaOH固体放在滤纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A. | 当溶液pH<4,碳钢主要发生析氢腐蚀 | |
| B. | 当溶液pH>13.5,碳钢腐蚀的正极反应式为O2+4H++4e-=2H2O | |
| C. | 当溶液pH>6,碳钢主要发生吸氧腐蚀 | |
| D. | 煮沸除去氧气的碱性溶液中,碳钢腐蚀速率会减缓 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C15H24O5 | B. | C15H18O4 | C. | C15H20O5 | D. | C15H12O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com