
����Ŀ��ij��ѧѧϰС����������´Ӻ������պ�ĺ���������ȡ�ⵥ�ʵ����̣� 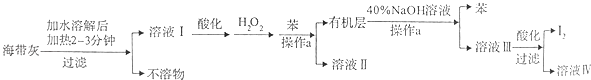
��1���ܽ⺣����ʱҪ�������2��3min��Ŀ���� �� ����a������Ϊ ��
��2�����ữ����ҺI�м���H2O2��Ŀ��Ϊ ��
��3����֪I2��40%��NaOH��Һ��Ӧ���ɵ���������ͻ�ԭ��������ʵ���֮��Ϊ1��5��д����Ӧ�Ļ�ѧ����ʽ ��
��4�������˵õ���I2��Ҫ����ϴ�Ӻ������ϴ�Ӽ�����Ӧ��ѡ�õ�������ѡ����ĸ����
A.ˮ
B.�Ҵ�
C.��ˮ
D.�Ҵ���ˮ��Һ
��5����Na2S2O3�ı���Һ�ⶨ��Ʒ�Ĵ��ȣ�������Ӧ��I2+2Na2S2O3=Na2S4O6+2NaI��ȡ5.0g��Ʒ�����Ƴ�100mL��Һ��ȡ10.00mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0��.050molL��1Na2S2O3�ı���Һ���еζ���������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����Na2S2O3����Һ�����/mL | 19.95 | 17.10 | 20.05 |
�ζ�ʱ���ﵽ�ζ��յ�������� �� �ⵥ���ڲ�Ʒ�е��������������ðٷ�����ʾ���ұ���1λС������
���𰸡�
��1���ӿ�I���ܽ⣬ʹ��������I��������ȫ���ܽ⣻��Һ
��2����I������ΪI2
��3��3I2+6NaOH=NaIO3+5NaI+3H2O
��4��C
��5���������һ�α���Һ����ɫ��Һǡ�ñ�Ϊ��ɫ�Ұ�����ڲ���ɫ��25.4%
���������⣺��1���ܽ⺣����ʱҪ�������2��3min�Ǽӿ��ܽ����ʣ�ʹ������ȫ���ܽ⣬����a�Ƿ���ⵥ�ʵ�ˮ��Һ�����뱽��Һ��ȥ�ⵥ�ʷֲ��Һ�õ����ⵥ�ʵ��л��㣬a����������Ϊ��Һ�����Դ��ǣ��ӿ�I���ܽ⣬ʹ��������I��������ȫ���ܽ⣻��Һ����2�����ữ����ҺI�м���H2O2��Ŀ��Ϊ��I������ΪI2 ��
���Դ��ǣ���I������ΪI2����3���ⵥ�ʺ�����������Һ��Ӧ�����绯��Ӧ����Ԫ�ػ��ϼ۽���Ϊ��1�۵õ���ԭ�������Ϊ���۵õ����������������ͻ�ԭ��������ʵ���֮��Ϊ1��5����ϵ����غ�������ߵĻ��ϼ�Ϊx��1����x��0��=5��[0������1��]��x=+5����Ӧ�Ļ�ѧ����ʽΪ��3I2+6NaOH=NaIO3+5NaI+3H2O��
���Դ��ǣ�3I2+6NaOH=NaIO3+5NaI+3H2O����4��I2��Ҫ����ϴ�Ӻ���ϴ�ӣ�ϴ��Һ���ܺ͵ⵥ�ʷ�����Ӧ�������ܽ�ⵥ�ʣ�
A��ˮ���ܽ�ⵥ�ʣ���A����
B���ⵥ���������Ҵ����������Ҵ�ϴ�ӵⵥ�ʣ���B����
C���ⵥ������ˮ���ܽ��Բ���������ϴ�ӵⵥ�ʣ���C��ȷ��
D���ⵥ���������Ҵ���ˮ��Һ����������ϴ�ӣ���D����
���Դ��ǣ�C����5���Ե�����ҺΪָʾ������Ũ��Ϊ0.050mol/L I2�ı���Һ���еζ����յ�����Ϊ��ɫ��Һǡ�ñ�Ϊ��ɫ�Ұ�����ڲ���ɫ�����ݱ������ݿ�֪���ڶ���ʵ�������ı���Һ�����ƫС����ȥ����ʵ������Na2S2O3����Һ�������ƽ��ֵ��= ![]() =20mL��
=20mL��
����ݷ�Ӧ�ķ���ʽ��֪��
2S2O32��+ | I2 | �� | S4O62��+ | 2I�� |
2 | 1 | |||
0.020L��0.05mol/L | n��I2�� |
������Ʒ��I2�����ʵ�����0.050mol/L��0.0200L�� ![]() ��10=0.005mol����ⵥ���ڲ�Ʒ�е���������=
��10=0.005mol����ⵥ���ڲ�Ʒ�е���������= ![]() ��100%=25.4%��
��100%=25.4%��
���Դ��ǣ��������һ�α���Һ����ɫ��Һǡ�ñ�Ϊ��ɫ�Ұ�����ڲ���ɫ��25.4%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о�֪Cu2+��H2O2�ֽ�Ҳ���д����ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�飮�ش�������⣺ 
��1�����Է�������ͼ��ͨ���۲� �� ���ԱȽϵó����ۣ�д��H2O2�ڶ������̴������·�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��������������ͼ����ʾ��ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ͼ������A������Ϊ �� ʵ������Ҫ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����������ͭ�Ļ�����������ʵ�飺 
��1���Լ�X�ǵ���ˮ������ղ��д�����Ⱥ��ʵ������ ��
��2��д����Ӧ�ٵĻ�ѧ����ʽ ��
��3��д��������ҺB�������ӵ�ʵ�鲽�衢������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��Ԫ�����ڱ���һ���֣�
��1������Ԫ�������ɣ�����Ԥ�⣬H3AsO4��H3PO4������ǿ����H3AsO4H3PO4�����������������=������
��2��Ԫ�ؼ��ǵ������ڽ���Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���Ԫ�ص������������ˮ��Ӧ�����ӷ���ʽΪ�� ��
��3�����ڱ�����10���������������Ԫ�أ�������һ�ֱ���Ϊ������Ԫ�ء�������Ԫ��R�����ӳ���������������Ҫ���ã���֪RԪ�ص�ԭ����4�����Ӳ㣬�����������ķ���ʽΪRO3 �� ��RԪ�ص�����Ϊ ��
A.��
B.��
C.��
D.��
��4���ʻ���COS�����ӽṹ�������̼���ӽṹ���ƣ�����ԭ�ӵ�����㶼����8���ӽṹ���õ���ʽ��ʾ�ʻ�����ӵ��γɹ��̣� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ɶ��������Ʊ�������ؿɷֶ������У���һ���������������������ع��۲�ͨ������2MnO2+4KOH+O2�T2K2MnO4+2H2O���ڶ���������������Һ��2K2MnO4+2H2O ![]() 2KMnO4+H2��+2KOH������˵����ȷ���ǣ� ��
2KMnO4+H2��+2KOH������˵����ȷ���ǣ� ��
A.�����������̣�ÿ����1molKMnO4 �� ��ת��6mol����
B.�ڶ������ʱ�������缫��ӦʽΪ2MnO42����2e��=2MnO4��
C.�ڶ����������ӷ���ʽΪ��2H2O ![]() H2��+OH��
H2��+OH��
D.�ڶ������ʱ������ΧpH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬԪ�ص�ԭ��
A. ������һ������ B. ������һ������
C. ������һ������ D. ���������һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe��OH��2���ױ�����������ʵ����������������Һ���ռӦ�Ƶð�ɫ������Fe��OH��2������������ͼ��ʾʵ��װ�ÿ��Ƶô�����Fe��OH��2�������������Ϸֱ�Ϊʯī������ 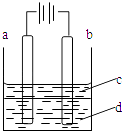
��1��a�缫����Ϊ �� ��缫��ӦʽΪ ��
��2�����Һd������ �� ���ɫ�����ڵ缫�����ɣ�Ҳ������ �� ���ɫ����������֮�����Һ�����ɣ�������ţ�
A����ˮ B��NaCl��Һ C��NaOH��Һ D��CuCl2��Һ
��3��Һ��cΪ������������ �� �ڼ��뱽֮ǰ����d��Һ���м�����д�����Ŀ���� ��
��4��Ϊ���ڶ�ʱ���ڿ�����ɫ�������ɲ�ȡ�Ĵ�ʩ�� �� ������ţ�
A.����ϡ���������Һ
B.�ʵ������Դ��ѹ
C.�ʵ���С���������
D.�ʵ����͵��Һ�¶�
��5����d��ΪNa2SO4��Һ�������һ��ʱ�䣬������ɫ�������ٷ��ӵ�Դ��������⣬���˵缫�Ͽ��������⣬��һ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ������������;�㷺�Ļ���ԭ�ϡ�
��1����ҵ�Ͽ������Կ�ʴ��Һ����Ҫ�ɷ���Cu2+��Fe2+��Fe3+��H+��Cl���Ʊ���ʽ̼��ͭ�����Ʊ��������£�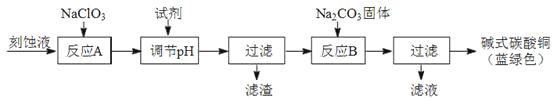
��֪��Cu2+��Fe2+��Fe3+���ɳ�����pH���£�
���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
��ʼ����pH | 4��2 | 5��8 | 1��2 |
��ȫ����pH | 6��7 | 8��3 | 3��2 |
�������Ƶ���������
�ڷ�ӦA�������Һ��pH��ΧӦΪ��
�۵�һ�ι��˵õ��IJ�Ʒϴ��ʱ������ж��Ѿ�ϴ������
���������ɫ��Ʒ�л���CuO���ʵ�ԭ������
��2��ijѧϰС����ʵ������������ͼ��ʾװ����ȡ������̽�������ʡ�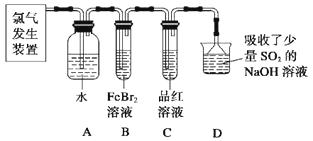
��ʵ�����ö������̺�Ũ���������ȡ����������������Ҫ��©����
����C��Ʒ����Һ��ɫ���ܷ�֤��������ˮ��Ӧ�IJ�����Ư���ԣ�˵��ԭ������ʱBװ���з�����Ӧ�����ӷ���ʽ����
��д��A��Һ�о���ǿ���������Ļ�ѧʽ������A��Һ�м���NaHCO3��ĩ����۲쵽����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��������ǽ���Ԫ�ظ������ҵ�(����)
A. �ư뵼���Ԫ�� B. ��ũҩ��Ԫ��
C. �ƴ�����Ԫ�� D. �����ºϽ��Ԫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com