
分析 (1)Na2FeO4 为强碱弱酸盐,在水溶液中易水解后溶液呈碱性,NaOH溶液呈碱性会抑制其水解.
(2)负极是锌,失去电子在氢氧化钠的条件下生成氢氧化锌,高铁酸钠转化为氢氧化铁红褐色沉淀.
解答 解:(1)Na2FeO4 为强碱弱酸盐,在水溶液中易水解后溶液呈碱性,NaOH溶液呈碱性会抑制其水解,有利于减少产品损失,故答案为:Na2FeO4 为强碱弱酸盐,在水溶液中易水解后溶液呈碱性,NaOH溶液呈碱性会抑制其水解,有利于减少产品损失;
(2)负极是锌,失去电子在氢氧化钠的条件下生成氢氧化锌,高铁酸钠转化为氢氧化铁红褐色沉淀,电池反应为:3Zn+2Na2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4NaOH,故答案为:3Zn+2Na2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4NaOH.
点评 该题考查了学生盐类水解的基本知识,影响盐类水解的因素,正确书写电池反应方程式,难度不大,要求具有扎实的基本功.


科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
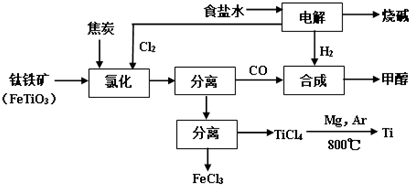
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| B | Fe3+、I-、ClO- | 少量NaOH溶液 | Fe3++3OH-=Fe(OH) 3↓ |
| C | Ca2+、Na+、OH- | 少量NaHCO3溶液 | HCO3-+OH-=CO32-+H2O |
| D | NH4+、HCO3-、Cl- | 少量NaOH溶液 | NH4++OH-=NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 | B. | 乙醇 | C. | 乙醛 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O.lmol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| B. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数为0.3NA | |
| C. | 电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA | |
| D. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子在原子核外排布时,总是尽先排在能量最高的电子层里 | |
| B. | 原子核外各电子层最多能容纳的电子数2n2,所以钾原子的M层有9个电子 | |
| C. | 稀有气体元素都形成了稳定的电子层结构,所以这些元素一定不存在化合态 | |
| D. | 在1~18号元素中,最外层电子数等于电子层数的元素有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH在5.6~7.0之间的降水通常被称为酸雨 | |
| B. | 计算机硅芯片,光导纤维,普通玻璃都属于硅酸盐产品 | |
| C. | 汽车尾车中的氮氧化物、一氧化碳、SO2和可吸入颗粒物等严重污染大气 | |
| D. | 在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com