
分析 (1)发生反应:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2,利用固体质量差量法计算ZnS的质量,进而计算样品中含硫化锌的质量分数;
(2)参加反应的硫酸得到ZnSO4及还原产物,根据滴定消耗的NaOH计算剩余硫酸物质的量,利用S原子守恒计算被含有硫酸的物质的量,再根据电子转移守恒计算还原产物中S元素化合价确定还原产物;
(3)反应后固体加入硫酸发生反应:Na2SO3+2Na2S+3H2SO4=3Na2SO4+3S↓+3H2O,可能剩余的Na2SO3不足,也可能是Na2S不足,据此讨论计算;
(4)SO2气体的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,SO2与NaOH作用可能的反应有:SO2+2NaOH=Na2SO3+H2O、SO2+NaOH=NaHSO3,
若只生成Na2SO3,则Na2SO3的质量是0.2mol×126g/mol=25.2g,若只生成NaHSO3,则NaHSO3的质量是0.2mol×104g/mol=20.8g,由于25.2<26.8,NaOH过量,溶质可能Na2SO3和NaOH;
由于Na2SO3易被氧化为Na2SO4,若只得到Na2SO4,则Na2SO3的质量是0.2mol×142g/mol=28.4g,由于25.2<26.8<28.4,反应后溶质可能为Na2SO3和Na2SO4,据此讨论计算.
解答 解:(1)设ZnS的质量是x,则:
2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2 固体质量减少
194 162 32
x 1.56g-1.32g=0.24g
即x=$\frac{0.24g×194}{32}$=1.455g,所以ZnS的质量分数=$\frac{1.455g}{1.56g}$×100%≈93%,
故答案为:93%;
(2)硫酸和氢氧化钠之间中和的实质是:H++OH-=H2O,取出15.00mL用0.25mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70mL,则剩余硫酸为:0.25mol/L×0.0217L×$\frac{1}{2}$×$\frac{1000mL}{15mL}$≈0.1808mol,消耗的硫酸的物质的量是0.012L×18.4mol/L-0.1808mol=0.040mol,金属锌的物质的量是:$\frac{1.95g}{65g/mol}$=0.03mol,生成硫酸锌的物质的量是0.03mol,设硫酸的还原产物中硫元素的化合价是n,根据电子守恒:0.03mol×(2-0)=(0.04mol-0.03mol)×(6-n),解得n=0,所以浓硫酸被还原的产物是硫单质,
故答案为:S;
(3)反应后固体加入硫酸发生反应:Na2SO3+2Na2S+3H2SO4=3Na2SO4+3S↓+3H2O,得到S的质量为0.96g,则:
Na2SO3+2Na2S+3H2SO4=3Na2SO4+3S↓+3H2O
126 156 96
1.26 1.56 0.96
若剩余的Na2SO3不足,则Na2SO3分解率为$\frac{20.16g-1.26g}{20.16g}$×100%=93.75%;
也可能是Na2S不足,则:
4Na2SO3$\frac{\underline{\;加热\;}}{\;}$3Na2SO4+Na2S
252 78
x 1.56g
x=$\frac{1.56g×252}{78}$=10.8g,
则Na2SO3分解率为$\frac{10.8g}{20.16g}$×100%=50%,
答:亚硫酸钠分解的百分率为93.75%或50%;
(4)SO2气体的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,SO2与NaOH作用可能的反应有:SO2+2NaOH=Na2SO3+H2O、SO2+NaOH=NaHSO3,
若只生成Na2SO3,则n(Na2SO3)=n(SO2)=0.2mol,则Na2SO3的质量是0.2mol×126g/mol=25.2g,若只生成NaHSO3,则NaHSO3的质量是0.2mol×104g/mol=20.8g,由于25.2<26.8,NaOH过量,溶质可能Na2SO3和NaOH,NaOH质量为26.8g-25.2g=1.6g,则NaOH的物质的量为$\frac{1.6g}{40g/mol}$=0.04mol;
由于Na2SO3易被氧化为Na2SO4,若只得到Na2SO4,则Na2SO3的质量是0.2mol×142g/mol=28.4g,由于25.2<26.8<28.4,反应后溶质可能为Na2SO3和Na2SO4,设二者物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.2}\\{126x+142y=26.8}\end{array}\right.$,解得x=y=0.1,
答:①第一种情况:n (NaOH)=0.04 mol、n (Na2SO3)=0.20 mol;
②另一种可能是Na2SO3和Na2SO4的混合物,n (Na2SO4)=n(Na2SO3)=0.10mol.
点评 本题是对化学计算的考查,侧重考查学生分析计算能力,涉及元素守恒、极端假设、电子转移守恒、讨论法等解题思维,难度较大.


科目:高中化学 来源: 题型:解答题
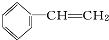 分子中,处于同一平面上的原子数最多可能16个.
分子中,处于同一平面上的原子数最多可能16个.
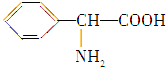 、
、 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
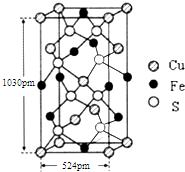 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
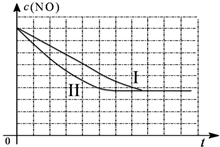
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
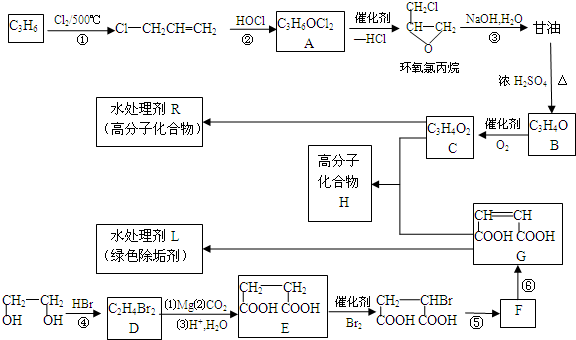
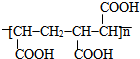 .
.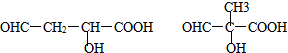
 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去污能力强 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 碳酸钡和硫酸钡都可以用做钡餐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com