
分析 (1)A、根据△G=△H-T△S判断;
B、反应进行到任何时候H2O与CO的生成速率之比都为1:1;
C、反应②属于取代反应;
(2)根据在燃料电池的负极上是燃料发生失电子发生氧化反应;
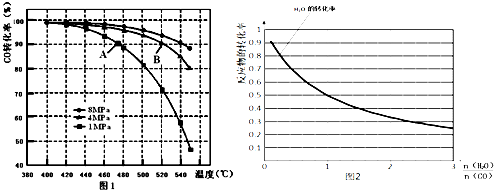
(3)B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率;
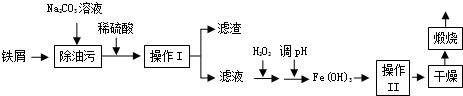
(4)根据化学平衡常数概念写K;由图可知,$\frac{n({H}_{2}O)}{n(CO)}$=1时水的转化率为0.5,令水、CO的起始物质的量均为1mol,转化的水为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
由于反应前后气体物质的量不变,用物质的量代替浓度代入K计算.
解答 解:(1)A、反应①的△S<0、△H<0,根据△G=△H-T△S判断:在较低温度下自发进行,A正确;
B、反应进行到任何时候H2O与CO的生成速率之比都为1:1,B错误;
C、反应②属于取代反应,C错误;
故答案为:A;
(2)燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH+8OH--6e-═CO32-+6H2O;
(3)B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率,故A点的v(逆)<B点的v(正);
故答案为:<;B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)的K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;
由图可知,$\frac{n({H}_{2}O)}{n(CO)}$=1时水的转化率为0.5,令水、CO的起始物质的量均为1mol,转化的水为0.5mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 0.5
平衡量(mol):0.5 0.5 0.5 0.5
由于反应前后气体物质的量不变,用物质的量代替浓度计算平衡常数,则平衡常数K=$\frac{0.5×0.5}{0.5×0.5}$=1;
故答案为:$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$;1.
点评 本题考查化学计算与影响因素、化学平衡图象、平衡状态判断、化学平衡常数、燃料电池电极式的书写、反应自发性等,综合性较强,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,在水中的溶解度Na2CO3>NaHCO3 | |
| C. | 相同质量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||
| B. | H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1其它相关数据如下表:
| |||||||||
| C. | 在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则热化学方程式为Fe(s)+S(s)═FeS(s);△H=-95.6 kJ•mol-1 | |||||||||
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为-241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 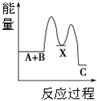 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. |  图表示反应的化学方程式为3A+B═2C | |
| C. | 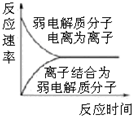 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 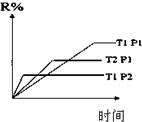 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com