
����Ŀ������þ[Mg��ClO3��2]����������������ݼ��ȣ�ʵ�����Ʊ�����Mg��ClO3��26H2O��������ͼ1�� 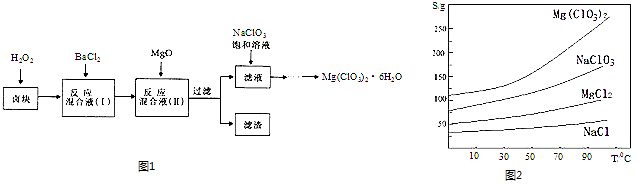
��֪����±����Ҫ�ɷ�ΪMgCl26H2O������MgSO4��FeCl2�����ʣ�
�����ֻ�������ܽ�ȣ�S�����¶ȣ�T��
�仯������ͼ2��ʾ���ش��������⣺
��1������ʱ��Ҫ�IJ��������� ��
��2������BaCl2��Ŀ���dz�ȥ�������ӣ������ѳ�����ȫ�ķ����� ��
��3������±����H2O2��Һ���ܽ�Ĵ�ʩ�У���д��һ�����ɣ�
��4������MgO���������� ��������Ҫ�ɷ�Ϊ ��
��5������Һ�м���NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaClO3=Mg��ClO3��2��+2NaCl���ٽ�һ����ȡMg��ClO3��26H2O��ʵ�鲽������Ϊ�����ڳ��ȹ��ˣ������ܹ��ˡ�ϴ�ӡ����
��6����Ʒ��Mg��ClO3��26H2O�����IJⶨ�� ����1��ȷ����3.50g��Ʒ���100mL��Һ��
����2��ȡ10.00mL����ƿ�У�����10.00mLϡ�����20.00mL 1.000molL��1��FeSO4��Һ���ȣ�
����3����ȴ�����£���0��l000molL��1K2Cr2O7��Һ�ζ�ʣ���Fe2+���յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��Cr2O72��+6Fe2++14H+=2Cr3++6Fe3++7H2O��
����4��������2��3�ظ����Σ������ƽ������K2Cr2O7��Һ15.00mL��
����д������2�з�����Ӧ�����ӷ���ʽ����ԭ����ΪCl����
�ڲ�Ʒ��Mg��ClO3��26H2O����������Ϊ �� ��������������λС����
���𰸡�
��1��©�������������ձ�
��2�����ã�ȡ�ϲ���Һ����BaCl2 �� ���ް�ɫ��������SO42��������ȫ
��3����±��������ȵ�
��4��������Һ��pH��ʹFe3+������ȫ��BaSO4��Fe��OH��3
��5������Ũ������ȴ�ᾧ
��6��ClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O��78.31%
���������⣺��1������ʵ���õ���������©�������������ձ�����ֽ������̨�ȣ����в��������У�©�������������ձ��� ���Դ��ǣ�©�������������ձ�����2����������������Ƿ�����ķ��������ã�ȡ�ϲ���Һ����BaCl2 �� ���ް�ɫ��������SO42��������ȫ����������þ��������Һ��pHΪ4����ʱ�������γ��˳��������������������Ѿ������������ֻ�Ӧ���������ᱵ������
���Դ��ǣ����ã�ȡ�ϲ���Һ����BaCl2 �� ���ް�ɫ��������SO42��������ȫ����3��Ӱ�컯ѧ��Ӧ���ʵ������У������¶ȡ�����������ϸС�Ŀ������������ʵ�Ũ�ȵȣ���˼���±����KMnO4��Һ���ܽ�Ĵ�ʩ�У���±��������ȵȣ�
���Դ��ǣ���±��������ȵȣ���4������������MgO�����ᷴӦ�����κ�ˮ�����Լ���MgO�������ǵ�����Һ��pH��ʹ����Fe3+�γɳ�����ȫ��ȥ������ʾ��ͼ��֪��������Ҫ�ɷ�ΪBaSO4��Fe��OH��3 ��
���Դ��ǣ�������Һ��pH��ʹFe3+������ȫ��BaSO4��Fe��OH��3����5������NaCl��Mg��ClO3��2���ܽ�����¶ȵĹ�ϵ����Һ����Ũ�������ȹ��ˡ���ȴ�ᾧ�������ˡ�ϴ�ӣ��͵õ�Mg��ClO3��26H2O��
���Դ��ǣ�����Ũ������ȴ�ᾧ����6������������Ӿ��������ԣ����Խ�������������Ϊ�����ۣ����ӷ���ʽΪClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O�����Դ��ǣ�ClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O���ڸ��ݻ�ѧ����ʽ��ClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O�Լ�Cr2O72��+6Fe2++14H+�T2Cr3++6Fe3++7H2O�����Եó���ClO3����6Fe2+ �� Cr2O72����6Fe2+ �� ��0.100molL��1 K2Cr2O7��Һ�ζ����յ���̿��Եó�ʣ����������ӵ����ʵ���Ϊ��0.100molL��1��0.015L��6=0.009mol������������ӷ�Ӧ���������ӵ����ʵ���Ϊ��20��10��3L��1.000molL��1��0.009mol=0.011mol����������ӵ����ʵ���Ϊ ![]() ��0.011mol����Ʒ��Mg��ClO3��26H2O��������������
��0.011mol����Ʒ��Mg��ClO3��26H2O�������������� ![]() ��0.011��299g/mol����10��
��0.011��299g/mol����10�� ![]() ��100%=78.31%��
��100%=78.31%��
���Դ��ǣ�78.31%��


 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ܵ���Ⱦ������Ⱦ����Ҫԭ���� (����)
�ٹ�ҵ�����з�Һ�������ŷš�����ˮ�������ij��ڽӴ�����ũҵ������ũҩ�����ʵĹ���ʩ�á��ܳ���������ˮ�������ŷ�
A.�٢ڢ�
B.�ڢۢ�
C.�٢ۢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ũҵ�����������������ɵ���ʧÿ��ߴ�15��Ԫ��Ϊ����Ч�������꣬Ŀǰ����Ժ�����ˡ�����������Ͷ���������Ⱦ���������ַ������ȷ��档ijʵ��С��ɼ�������������Ʒ������ʱ������ƣ���βⶨ����Ʒ��pH���õ��˱������ݣ�(��֪pHԽС����Һ������Խǿ)
ʱ��(h) | 0 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
��1��������Ʒ����ʱpH�仯����Ҫԭ����(�û�ѧ����ʽ��ʾ)��
��2���������ȡ�����������������ˮ��ϣ�pH��(�������С�����䡱)��ԭ����(�û�ѧ����ʽ��ʾ)��
��3������Ϊ������������ɲ�ȡ�Ĵ�ʩ��___________(����ĸ)��
������ú��ȼ�� �ڰѹ����̴���� ��ȼ������ �������ữ�������м�ʯ�� �ݿ�������Դ
A.�٢ڢ�
B.�ڢۢܢ�
C.�٢ۢ�
D.�٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����գ�
��1��NH3��O2 ![]() NO��H2O���÷�Ӧ���������� �� ��������Ԫ���� �� ������������
NO��H2O���÷�Ӧ���������� �� ��������Ԫ���� �� ������������
��2������1 mol O2�μӣ���Ӧ��ת�Ƶ�����mol��
��3����ƽ�÷�Ӧ����ʽ���õ����ű������ת�Ƶķ������Ŀ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1�����ݷ�Ӧ8NH3+3Cl2=6NH4Cl+N2 �� �ش��������⣺
�ٸ÷�Ӧ���������� �� ������������
�ڸ÷�Ӧ�б������������뱻��ԭ���������ʵ���֮��Ϊ��
��2��ijһ��Ӧ��ϵ�д�������6�����ʣ�NO��FeSO4��Fe(NO3)3��HNO3��Fe2(SO4)3��H2O����֪��������ת����ϵ��HNO3��NO����������и��⣺
�ٸ÷�Ӧ���������� �� ��ԭ������
�ڸ÷�Ӧ��1 mol������(��õ�����ʧȥ��)mol���ӡ�
�۵���0.1 mol HNO3����ԭ����ʱ���ɱ�״����NO�������L��
����Ѹ�������������ո�����ƽ��
+��=��+��+��+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A.��16g18O2�к���NA����ԭ��
B.��״���£�22.4L��������NA�����ʷ���
C.1 molL��1��NaClO ��Һ�к���ClO������Ŀ����NA��
D.12gMg�ڿ�������ȫȼ������MgO��Mg3N2 �� ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ�д����������
A. Fe2+��H +��Na+��NO3��B. SiO32-��K+��Br����H +
C. NH4+��Cl����Mg2+��SO42-D. Na +��OH����NH4+��I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ��������ȷ����(����)
A.AlCl3��Һ������ˮ����Al(OH)3B.Mg��CO2��ȼ������MgCO3
C.Fe(OH)3�������������FeI3D.SiO2��H2O��Ӧ����H2SiO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĸ��ֻ��������ճ����������Ź㷺Ӧ�ã�������ѧ֪ʶ�ش��������⣺
��1����֪1g H2S������ȫȼ�գ�����Һ̬ˮ�Ͷ����������壬�ų�17.24kJ��������д��H2S����ȼ���ȵ��Ȼ�ѧ��ʽ�� ��
��2����֪��������NaHSO3��Һ��c��H2SO3 ����c��SO32���� ��H2SO3 �ĵ���ƽ�ⳣ��Ϊ��K1=1.5��10��2 K2=1.1��10��7����ˮ�ĵ���ƽ�ⳣ��ΪK=1.8��10��2�� ��i��������ʵ���Ũ�ȵ�����������Һ����NH3H2O ��KHSO3����KHCO3 ��Һ��ˮ�ĵ���̶��ɴ�С����˳��Ϊ
��ii��0.1molL��1��NaHSO3��Һ��C��H+��C��OH����������������������=������
��3����֪25��ʱKsp[Cu��OH��2]=2.2��10��20 �� Ksp[Fe��OH��2]=8.0��10��16 �� KspFe��OH��3]=4.0��10��38 �� Ksp[Al��OH��3]=1.1��10��33��i����25���£���Ũ�Ⱦ�Ϊ0.1mol/L��AlCl3��CuCl2�����Һ����μ��백ˮ���������������ѧʽ����
��ii����1.0mol Fe2��SO4��3��1.0mol FeSO4��1L���Ի����Һͨ��NH3 �� ������Һ��PHΪ3ʱ��������Һ��c��Fe2+����c��Fe3+��= ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com