


科目:高中化学 来源:不详 题型:单选题

| A.镁比铝活泼,因此镁电极作电源负极 |
| B.铝是电池负极,其电极反应式为Al-3e- +3OH-=Al(OH)3 |
| C.该装置的内、外电路中,均是电子的定向移动形成电流 |
| D.该装置开始工作时,铝片表面的氧化膜不必处理 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
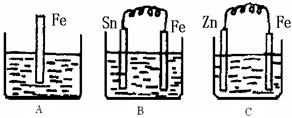
| A.该装置能形成原电池,其中铝是负极 |
| B.该装置能形成原电池,其中铜是负极 |
| C.该装置不能形成原电池 |
| D.以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H++2e-=H2↑ | B.Zn-2e-=Zn2+ |
| C.2H2O+O2+4e-=4OH- | D.Ag++e-=Ag |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

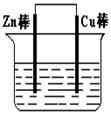
| A.该装置中电子由Zn极流向Cu极,溶液中的SO42-通过盐桥移向Zn极 |
| B.将上述装置中的Zn棒和Cu棒同时浸入CuSO4溶液,电流计的指针偏转幅度变小,且很快减弱 |
| C.将烧杯内溶液对换,电流计指针也能发生偏转 |
| D.将盐桥改为铜导线连接两种溶液,电流由Cu极移向Zn极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com