
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为__。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是__(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__。
②让反应停止的操作方法及原因是__。
(4)以下收集NO气体的装置,合理的是__(填字母)。
A. B.
B.![]() C.
C.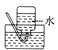 D.
D.![]() E.
E.![]()
【答案】3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ CD 2NO+O2=2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止 CD
【解析】
(1)Cu与硝酸反应生成硝酸铜、NO和水,以此书写离子反应;
(2)①根据试验的目的是证明金属铜和硝酸之间的反应,根据目的选择所用的材料;
②图1中试管内有空气,NO被氧化为红棕色的气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据一氧化氮的溶解性与氧气的反应确定收集方法。
(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①若实验室没有铜丝,以铜粒代替铜丝进行实验,由于铁和铝的活泼性均强于铜,其先与硝酸发生反应,因此,不能用铁丝和铝丝包裹铜粒。由于玻璃和铂不与硝酸反应,可以用其包裹铜粒,故选CD;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2;
(3)①一氧化氮是微溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,若关闭出气口,气体可把U形管中的液体压出,因此,长玻璃管的作用为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止,则应该使铜和稀硝酸分开,具体操作方法及原因是关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,故答案为:关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)由于一氧化氮与氧气在常温下反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E排水法收集装置,应该短进长出,所以D正确,E错误,故选:CD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组中两种溶液间的反应,均可用同一离子方程式表示的是( )
A.HCl+Na2CO3、HCl+NaHCO3B.BaCl2+Na2SO4、Ba(OH)2+H2SO4
C.石灰石与硝酸、石灰石与盐酸D.KOH+HCl、Ba(OH)2+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取7.90g KMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素只以Mn2+存在。下列说法中错误的是( )
A.反应过程中生成氧气的物质的量是0.015mol
B.气体A是氯气,它的物质的量是0.095mol
C.KMnO4的分解率是60%
D.整个反应过程中转移了0.19mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
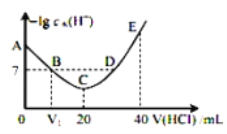
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中A为银白色固体,B为淡黄色固体,它们有如图所示的转化关系:
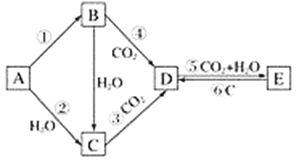
(1)推断各符号所代表的物质的化学式:
A________________,B________________,C________________,D________________,E________________。
(2)分别写出反应②⑤的化学方程式:
②________________________________________________________________________;
⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,三个干燥的烧瓶内分别装入:干燥纯净的氨气、含有部分空气的氯化氢气体、体积比为4∶1的二氧化氮与氧气的混合气体。分别做喷泉实验,最终三个烧瓶中所得溶液的物质的量浓度(假设溶液不外渗)之比为( )
A.2∶1∶2B.5∶5∶4C.1∶1∶1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
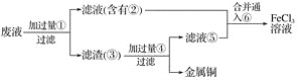
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.![]() 最多有16个原子共平面
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是( )

A.b电极的反应式为CH3OCH3+3H2O-12e-=2CO2↑+12H+
B.试剂A为饱和食盐水,试剂B为NaOH稀溶液
C.阴极生成1mol气体时,理论上导线中流过2mole-
D.阳极生成1mol气体时,有1mol离子通过离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com