
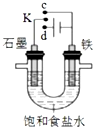
| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
分析 A、若K与c连接,是原电池,石墨电极是正极,电极反应为:O2+4e-+2H2O=4OH-;
B、若K与c连接,是原电池,原电池中的Na+向正极移动;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H++2e-═H2↑;
D、若K与d连接,一段时间后是电解饱和食盐水,产生氢气和氯气,所以加入氯化氢气体可使电解质溶液复原.
解答 解:A、若K与c连接,是原电池,石墨电极是正极,是吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH-,故A错误;
B、若K与c连接,是原电池,原电池中的Na+向正极移动,所以钠离子向石墨极移动,故B错误;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H++2e-═H2↑,故C正确;
D、若K与d连接,一段时间后是电解饱和食盐水,产生氢气和氯气,所以加入氯化氢气体可使电解质溶液复原,而不是深度电解,故D错误;
故选C.
点评 本题考查原电池与电解原理,难度不大,电化学的有关知识一直是高考考查的重点,原电池与电解池的本质都是氧化还原反应,注意掌握电解池中离子放电顺序.


科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3受热易分解,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3熔点高,可用作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
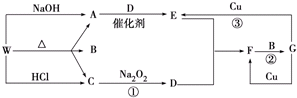
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
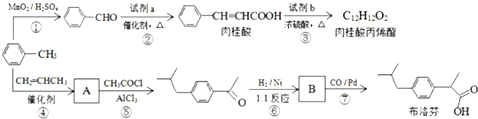
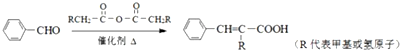
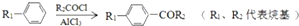
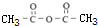 ;
;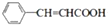 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$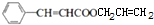 +H2O;
+H2O; ;
;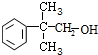 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
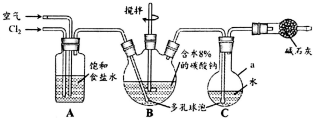 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com