
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
分析 A.醋酸为弱酸,电离吸热;
B.能量越低越稳定;
C.应为1mol氢气;
D.碳的燃烧为放热反应,完全燃烧放出的热量多.
解答 解:A.醋酸为弱酸,电离吸热,氢氧化钠和醋酸反应,生成1mol水放出的热量少于57.4kJ,故A错误;
B.已知C(石墨,s)=C(金刚石,s);△H>0,说明石墨能量低,则石墨稳定,故B错误;
C.燃烧热指1mol氢气燃烧放出的热量,故C错误;
D.碳的燃烧为放热反应,完全燃烧放出的热量多,反应热为负值,则放出的热量越多值越小,故D正确.
故选D.
点评 本题考查了热化学方程式等知识,为高频考点,侧重于学生的分析能力的考查,注意把握燃烧热,中和热概念的理解应用,题目难度中等.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1=△H2=△H3 | B. | △H2<△H1<△H3 | C. | △H2=△H3>△H1 | D. | △H2=△H3<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,NA个CCl4分子所占的体积为22.4 L | |
| B. | 常温常压下,18 g H2O中含有的原子总数为3NA | |
| C. | 标准状况下,2.24 L SO3中含有的分子数目为0.1NA | |
| D. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.9gNa2O2固体中含有的阴离子数为0.05 NA | |
| B. | 标准状况下,2.24LCCl4所含原子数为0.5 NA | |
| C. | 1L 0.1mol/L醋酸溶液中含有的CH3COOH分子数为0.1 NA | |
| D. | 56g铁丝与一定量Cl2发生反应,当铁粉反应完全时,电子转移的数目可能为2.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,2.24L SO3中所含原子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
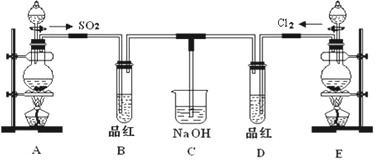
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
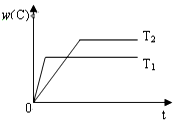 对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )
对于反应A(g)+2B(g)?2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示.则下列结论正确的是( )| A. | T1>T2,正反应放热 | B. | T1<T2,正反应放热 | ||
| C. | T1>T2,正反应吸热 | D. | T1<T2,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56L | B. | 1.68L | C. | 2.24L | D. | 1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、I- | B. | Br-、I-、Cl- | C. | Br-、Cl-、I- | D. | Cl-、I-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com