
分析 (1)发生反应有:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)生成的气体为氧气与氢气,过氧化钠与Al都完全反应,设过氧化钠与Al的物质的量分别为x mol、y mol,根据二者质量之和及生成气体的体积之和列方程计算,生成偏铝酸钠的物质的量,再根据c=$\frac{n}{V}$计算反应后溶液中NaAlO2的物质的量浓度.
解答 解:(1)发生反应有:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以有铝参加的反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)生成的气体为氧气与氢气的混合物,
设过氧化钠与Al的物质的量分别为x、y,过氧化钠与Al都反应,则:
2Na2O2+2H2O=4NaOH+O2↑,
x 2x 0.5x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
y y y 1.5y
则:78x+27y=21、0.5x+1.5y=$\frac{8.96L}{22.4L/mol}$=0.4mol,
解得:x=0.2mol、y=0.2mol,所以氧气的物质的量为:0.2mol×0.5=0.1mol,氢气的物质的量为:0.2mol×1.5=0.3mol,标况下体积之比等于物质的量之比:1:3;反应后溶液中NaAlO2的物质的量浓度是$\frac{0.2mol}{0.1L}$=2mol/L,故答案为:氧气、氢气;1:3;2mol/L.
点评 本题考查混合物反应的有关计算,为高频考点,题目难度中等,注意题目中反应物全部反应,明确反应实质为解答关键,试题培养了学生的化学计算能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中金属元素与非金属元素交界线附近的元素既具有一定的金属性也具有一定的非金属性,所以它们属于过渡元素 | |
| B. | 若M2+和N2-的核外电子层结构相同,则原子序数:N>M | |
| C. | 元素周期表的短周期元素中,最外层电子数是其电子层数2倍的元素共有4种 | |
| D. | 在元素周期表中,原子序数差值为2的两种元素有可能处于同一主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的水溶液能导电,所以SO2是电解质 | |
| B. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| C. | 所有的共价化合物都是弱电解质,所有的离子化合物都是强电解质 | |
| D. | 强酸、强碱及大部分盐类都属于强电解质,弱酸、弱碱都属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
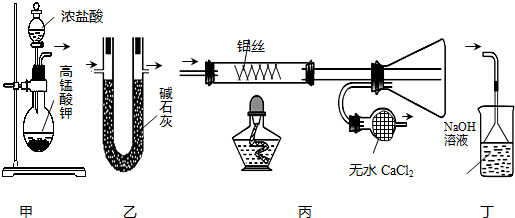
| A. | 用装置甲制取氯气 | B. | 用装置乙干燥氯气 | ||
| C. | 用装置丙制取并收集AlCl3 | D. | 用装置丁处理丙中排出的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
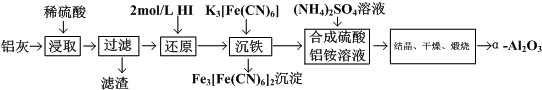
| A. | 加热搅拌可以提高铝灰的浸取率 | |
| B. | 流程中的HI,可以用H2O2代替 | |
| C. | 流程中的K3[Fe(CN)6],可以用NaOH溶液代替 | |
| D. | 流程中的得到硫酸铝按晶体的具体方法为:蒸发结晶、趁热过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O | |
| B. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++O3-═3Fe3++NO↑+2H2O | |
| C. | 硝酸银溶液中加入铜粉:Cu+Ag+═Cu2++Ag | |
| D. | 常温下,浓硝酸与铁屑混合:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com