
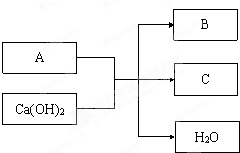
| ||
| ||


科目:高中化学 来源: 题型:
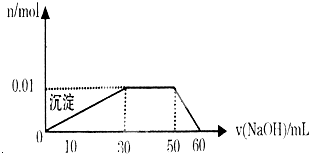
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、Na+、NO3-、CO32- |
| B、Mg2+、Cl-、NH4+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
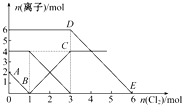 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | V | W | X | Y | Z |
| 原子半径(×0.1nm) | 0.37 | 0.77 | 0.75 | 0.74 | 1.85 |
| 电负性 | 2.1 | 2.5 | 3.0 | 3.5 | 1.66 |
| 常见化合价 | +1 | +4,-4 | +5,+3,-3 | -2 | +6,+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、只有①③⑤ |
| C、②③⑤⑥ | D、只有③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不变 | B、增大 |
| C、减小 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5Cl2+I2+6H2O=10HCl+2HIO3 |
| B、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
| C、MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑ |
| D、2NaCl+2H2O=2NaOH+Cl2↑+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com