
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应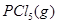
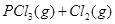 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
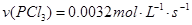
 ,则反应的
,则反应的
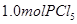 、
、 和
和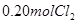 ,达到平衡前v(正)>v(逆)
,达到平衡前v(正)>v(逆)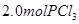 、
、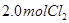 ,达到平衡时,
,达到平衡时, 的转化率小于80%
的转化率小于80% C
解析试题分析: A、由表中数据可知50s内,△n(PCl3)=0.16mol,根据v=△n/v△t计算v(PCl3)=0.0016mol/(L?s),错误; B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)="0.11" mol/L,则n′(PCl3)="0.11" mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,错误;C、利用三行式求的该反应的平衡常数k=0.025,起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Q=0.02,Q<K,说明反应向正反应方向进行,反应达平衡前v(正)>v(逆),正确;D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于80%,错误。
考点:考查反应速率、平衡常数计算、平衡移动、等效平衡等。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:单选题
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)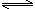 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,向容积固定且不变的某密闭容器中充入a mol NO2,发生如下反应:
2NO2(g)  N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
| A.平均相对分子质量增大 | B.NO2的转化率提高 |
| C.NO2的质量分数增大 | D.反应放出的总热量大于原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: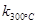 >
>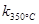 ,且体系中
,且体系中 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g) xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是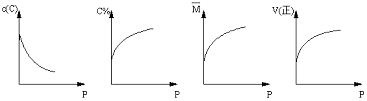
A B C D
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应H2(g) + I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A.H2(g)的消耗速率与HI(g)的生成速率比为2:1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率不一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是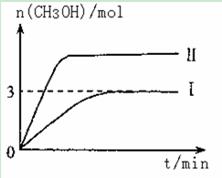
| A.曲线II对应的条件改变是减小压强 |
| B.若T2°C时上述反应的平衡常数为0.42,则T2< T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D.在T10C,若起始时向容器中通入4 .5 molCO2、6mol H2 ,平衡时容器内的压强P1=P/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
| A.碳酸铵分解是吸热反应,根据焓判据判断能自发分解 |
| B.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大,越混乱,熵值越大 |
| C.水总是自发地由高处往低处流,这是一个自发反应 |
| D.室温下水结成冰是自发过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com