
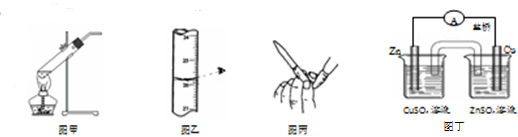
| A. | 用图甲所示装置加热分解NaHCO3固体 | |
| B. | 用图乙所示读取滴定管读数 | |
| C. | 用图丙所示排碱式滴定管尖嘴内的气泡 | |
| D. | 用图丁所示装置构成铜锌原电池 |
分析 A.加热固体时,应防止试管炸裂;
B.读数滴定管时眼睛应平视;
C.气泡密度较小,将胶管弯曲使玻璃尖嘴斜向上,捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,可将气泡赶出;
D.含有盐桥的原电池中,金属电极材料与其盐溶液中金属阳离子为同一金属元素.
解答 解:A.加热碳酸氢钠分解生成二氧化碳、碳酸钠和水,应防止水倒流而使试管炸裂,故A错误;
B.读数滴定管时眼睛应平视,否则导致实验误差,故B错误;
C.气泡密度较小,将胶管弯曲使玻璃尖嘴斜向上,捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,可将气泡赶出,故C正确;
D.含有盐桥的原电池中,金属电极材料与其盐溶液中金属阳离子为同一金属元素,该装置中锌电极应该插入硫酸锌溶液中,故D错误.
故选C.
点评 本题考查较为综合,涉及药品的加热、原电池、滴定管的使用等操作,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握实验方法和注意事项,难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
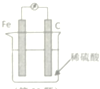
| A. | 在铁棒上产生气泡,碳棒上没有气泡 | |
| B. | H+在溶液中定向流向铁 | |
| C. | 电子由铁电极经导线流向碳棒 | |
| D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Na+、ClO- | B. | Cu2+、Ba2+、OH-、Cl- | ||
| C. | Ca2+、K+、Al3+、CO32- | D. | NH4+、NO3-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是6 | B. | 质子数是6 | C. | 电子数是14 | D. | 中子数是14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | C. | 反应物 | D. | 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com